
【题目】下列实验操作中正确的是( )
A.用水分离四氯化碳和酒精的混合物
B.蒸馏完毕时,先再停止加热,关闭冷凝水
C.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸 馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
D.将放在称量纸上称取的NaOH固体在烧杯中溶解,待冷却后,再转移至容量瓶
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:

①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种主族元素分属三个短周期;且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。请用化学用语回答下列问题:
(1)G简单离子的结构示意图为____,Y、Z、M简单离子的半径由大到小的顺序为____(用离子符号表示)。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是___(填化学式);Y、M的简单氢化物沸点较高的是____(填化学式),组成该物质的分子的空间结构为_____。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写两种,填化学式)。
(4)Z、Y两种元素的单质在加热条件下可发生反应,产物的电子式为______。
(5)M的单质与其最高价氧化物对应水化物反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为_____________________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是__________________。
(3)实验室利用下图装置制取无水AlCl3。
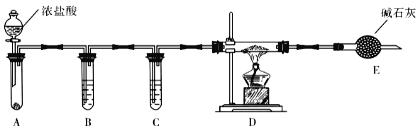
①A中所盛装的试剂是_______________。
②点燃D处酒精灯之前需排除装置中的空气,其操作是______________________。
(4)改变A和D中的试剂就可以用该装置制取NaH,若装置中残留有氧气,制得的NaH中可能含有的杂质为____________
(5)现设计如下四种装置,测定铝氢化钠粗产品(只含有NaH杂质)的纯度。

从简约性、准确性考虑,最适宜的装置是_________(填编号)。称取15.6g样品与水完全反应后,测得气体在标准状况下的体积为22.4L,样品中铝氢化钠的质量分数为___________。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C. SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D. SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A. 温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置不能达到有关实验目的是( )

A. 用甲图装置证明ρ(煤油)< ρ(钠)< ρ(水)
B. 用乙图装置可以吸收氨气防止倒吸
C. 用丙图装置制取金属锰
D. 用丁装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
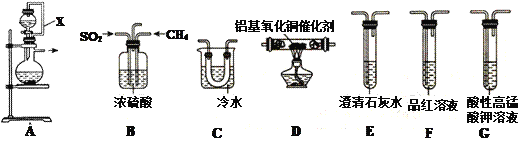
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 .![]() 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com