
| A. | ②不对 | B. | ③④不对 | C. | ①④不对 | D. | 全部正确 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
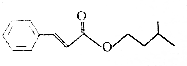
| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能与新制的Cu(OH)2共热生成红色沉淀 | |
| C. | 能与FeCl3溶液反应显紫色 | |
| D. | 能与热的浓硝酸和浓硫酸混合液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
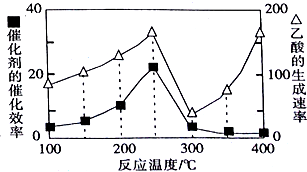
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com