
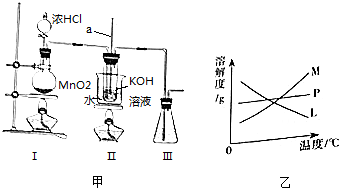
分析 (1)Ⅱ中玻璃管a的作用是平衡压强,防止压强改变液体倒吸;
(2)装置Ⅰ是制备氯气的装置,生成的氯气中含有氯化氢和水蒸气,仪器进入装置Ⅱ,氯化氢也消耗氢氧化钾,需要通入前除去;
(3)在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,溶质的溶解度随温度的降低而降低,不溶性固体与液体的分离常采用过滤的方法;
(4)①用双氧水除去溶液中残留ClO-的反应是利用次氯酸根离子的强氧化性氧化过氧化氢生成氧气,本身被还原生成氯离子,结合原子守恒和电子守恒、电荷守恒配平书写;
②依据过程中的反应ClO3-+6I-+6H+=Cl-+3I2+3H2O和2S2O32-+I2═S4O62-+2I-,得到关系ClO3-~3I2~6S2O32-,结合实验过程中的数据计算;
③滴加双氧水至不再产生气泡,煮沸除去混有的氧气,避免氧气氧化碘离子为碘单质,消耗Na2S2O3标准溶液体积增大.
解答 解:(1))Ⅱ中玻璃管a的作用为平衡压强,防止压强改变液体倒吸,故答案为:平衡压强;
(2)装置Ⅰ是制备氯气的装置,生成的氯气中含有氯化氢和水蒸气,仪器进入装置Ⅱ,氯化氢也消耗氢氧化钾,为了提高KOH的利用率需要通入前除去,在Ⅰ与Ⅱ之间连接盛有饱和食盐水的净化装置,除去氯化氢气体,
故答案为:在Ⅰ与Ⅱ之间连接盛有饱和食盐水的净化装置;
(3)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,不溶性固体与液体的分离常采用过滤的方法,过滤需要的仪器为烧杯、铁架台、玻璃棒、漏斗等,不需要的仪器为B.长颈漏斗、D.蒸发皿、F.酒精灯,
故答案为:M;BDF;
(4)①用双氧水除去溶液中残留ClO-的反应是利用次氯酸根离子的强氧化性氧化过氧化氢生成氧气,本身被还原生成氯离子,反应的离子方程式为:ClO-+H2O2═H2O+Cl-+O2↑,
故答案为:ClO-+H2O2═H2O+Cl-+O2↑;
②反应ClO3-+6I-+6H+=Cl-+3I2+3H2O和2S2O32-+I2═S4O62-+2I-,得到关系ClO3-~3I2~6S2O32-,注意溶液体积的关系,
ClO3-~3I2~6S2O32-,
1 6
n 0.500mol/L×0.0480L×$\frac{100}{20}$
n=0.02mol
晶体中KClO3的质量分数=$\frac{0.02mol×122.5g/mol}{3.00g}$×100=81.7%,
故答案为:81.7%;
③滴加双氧水至不再产生气泡,煮沸除去混有的氧气,避免氧气氧化碘离子为碘单质,消耗Na2S2O3标准溶液体积增大,所测KClO3的质量分数偏高,
故答案为:偏高.
点评 本题考查了物质组成、物质检验、物质分离的方法、实验基本操作和反应定量的计算等知识,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:
已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:| 物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L己烷中共价键数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中含有的碳原子数为2NA | |
| D. | 足量Fe与标准状况下22.4 L Cl2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45 kJ/mol | B. | +32.7 kJ/mol | C. | -45 kJ/mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com