

分析 (1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O;
(2)①H2(g)+A(l)=B(l)△H1,②O2(g)+B(l)=A(l)+H2O2(l)△H2,两反应的△S<0,根据△G=△H-T△S,因为均为两反应自发反应,因此△H均小于0,将①+②得:H2(g)+O2(g)=H2O2(l)的△H=△H1+△H1<0;
(3)MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx;c.若降温,平衡正向移动,该反应的平衡常数增大;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢);
(4)利用太阳能直接分解水制氢,是将光能转化为化学能;
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低.
解答 解:(1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,
故答案为:污染小、可再生、来源广、资源丰富、燃烧热值高;H2+2OH--2e-=2H2O;
(2)①H2(g)+A(l)=B(l)△H1,②O2(g)+B(l)=A(l)+H2O2(l)△H2,两反应的△S<0,根据△G=△H-T△S,因为均为两反应自发反应,因此△H均小于0,将①+②得:H2(g)+O2(g)=H2O2(l)的△H=△H1+△H2<0,
故答案为:<;
(3)MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变,正确;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx,错误;c.若降温,平衡正向移动,该反应的平衡常数增大,正确;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢),错误;
故选ac;
(4)利用太阳能直接分解水制氢,是将光能转化为化学能,
故答案为:将光能转化为化学能;
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH-)降低的区域在阳极室,
故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,
故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,
故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低).
点评 本题主要考查了化学反应中的能量变化、化学平衡状态的判断、电解原理及其应用的相关知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
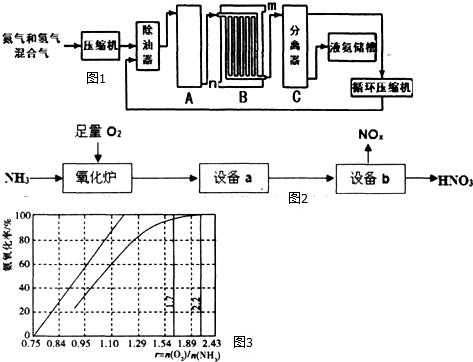
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
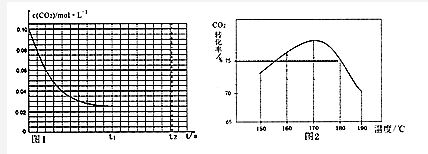
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
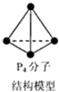
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
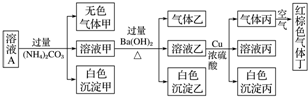
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com