
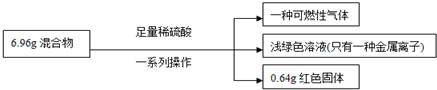
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
| 0.64g |
| 64g/mol |
| 6.16g |
| 56g/mol |


科目:高中化学 来源: 题型:
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 | ||||
B、惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- | ||||
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
| A、实验1中溶解的金属是铁且质量为4.2g |
| B、实验2中4.8g金属的组成是铁与铜 |
| C、实验4发生反应的离子方程式:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| D、实验4中V的数值为4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤⑦ | B、③④⑥⑦ |
| C、①②⑤⑥ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲 | B、乙 | C、丙 | D、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5g | B、10g |
| C、20g | D、30g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mol;70% |
| B、20mol;30% |
| C、40mol;35% |
| D、10mol;50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe和Zn |
| B、Al和Zn |
| C、Mg和Al |
| D、Fe和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com