
【题目】下列关于青铜性质的说法,不正确的是( )
A. 熔点比纯铜低 B. 能够导电 C. 能够导热 D. 硬度比纯铜小
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是

A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol X和2mol Y充入2L密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol·L-1,下列叙述错误的是( )
2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol·L-1,下列叙述错误的是( )
A. a的值为2
B. 平衡时X的浓度为0.8mol·L-1
C. 平衡时Y的转化率60%
D. 0~2min内Y的反应速率为0.6mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(mm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
(1)Z离子的结构示意图为_______________。
(2)关于Y、Z两种元素,下列叙述正确的是__________(填序号)。
a 简单离子的半径Y>Z
b 气态氢化物的稳定性Y比Z强
c 最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是____________________________。一段时间后,观察到试管中的现象是_________________________,发生反应的离子方程式是___________________________。
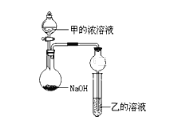
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是: 2XO2+2NaOH=M+NaXO3+H2O (已配平),产物M中元素X的化合价为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小粒钠投入盛有硫酸铜溶液的小烧杯中,不可能观察到的现象是( )
A. 溶液中出现蓝色絮状沉淀 B. 有红色的铜被置换出来
C. 钠粒熔成小球浮在水面四处游动 D. 有气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
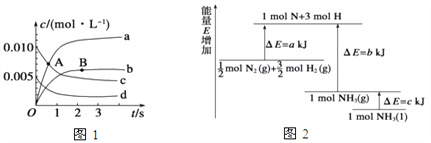
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸通常以二水合物的形式存在,俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O。
(1)下列关于乙二酸的叙述正确的是(填编号)_____________
①能和乙二醇发生酯化反应
②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红
④能和碳酸氢钠溶液反应生成气体
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下,用空气氧化得到.写出该反应的化学反应方程式:__________________________________
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2来完成实验.
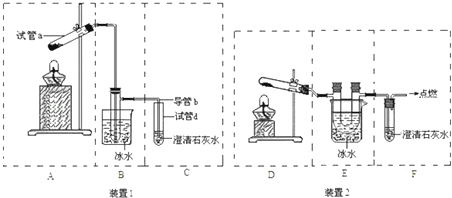
(Ⅰ)简述检验装置1气密性的操作方法:______________________________________
(Ⅱ)B和E两个装置中更合理的是______________
(Ⅲ)请从A~F中选择合适的仪器,组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为(用字母表示):________________.
(Ⅳ)一定条件下草酸氢铵分解生成NH3、CO、CO2和H2O,110℃时将该混合气体先通过Na2O2,再通过浓硫酸分别增重Ag和Bg; 若将混合气体先通过浓硫酸,再通过Na2O2分别增重Cg和Dg(能反应的气体均可吸收完全,且该条件下CO与Na2O2不反应),则A、B、C、D的大小关系为:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
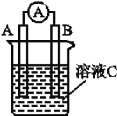
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(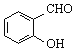 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com