
| A. | 该反应是复分解反应 | B. | 该反应1molCl2得到2mole- | ||
| C. | 反应中Cl2既是氧化剂,又是还原剂 | D. | NaClO2和ClO2中Cl的化合价相同 |
分析 在Cl2+2NaClO2═2ClO2+2NaCl反应中,Cl2中Cl元素的化合价为0价降低到-1价的NaCl,NaClO2中Cl元素的化合价为+3价升高到+4价的ClO2,则NaClO2是还原剂,Cl2是氧化剂,据此分析解答.
解答 解:A.Cl2+2NaClO2═2ClO2+2NaCl反应中,Cl2中Cl元素的化合价为0价降低到-1价的NaCl,NaClO2中Cl元素的化合价为+3价升高到+4价的ClO2,则该反应为氧化还原反应,故A错误;
B.Cl2+2NaClO2═2ClO2+2NaCl反应中,Cl2中Cl元素的化合价为0价降低到-1价的NaCl,所以该反应1molCl2得到2mole-,故B正确;
C.Cl2+2NaClO2═2ClO2+2NaCl反应中,Cl2中Cl元素的化合价为0价降低到-1价的NaCl,则Cl2是氧化剂,故C错误;
D.NaClO2中Cl元素的化合价为+3价,ClO2中Cl的化合价为+4价,故D错误;
故选B.
点评 本题考查氧化还原反应,难点Cl元素的化合价的判断及其变化,会根据化合价的变化判断是解题的关键,难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制漂白粉:Cl2+2NaOH═NaCl+NaClO+H2O | |
| B. | 工业制粗硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| C. | 工业合成氨:N2+3H2 $?_{催化剂}^{高温高压}$ 2NH3 | |
| D. | 工业炼铁:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
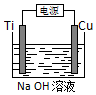 (1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).
(1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与乙醇反应时的反应速率比与水反应时的慢 | |
| B. | 除去乙烷中混有的少量乙烯的方法可以是将其通入溴的四氯化碳溶液中 | |
| C. | 已知 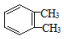 和 和 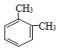 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 | |
| D. | .苯不能使酸性高猛酸钾溶液褪色,所以苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化、石油分馏、煤的气化、石油中提取石蜡都是化学变化 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| D. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CH3Cl中所含质子数为26NA | |
| B. | 将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA | |
| C. | 常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA | |
| D. | 0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com