
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
科目:高中化学 来源: 题型:选择题
| A. | 降低了化学反应的焓变 | |
| B. | 催化剂能同等程度地加快正逆反应速率 | |
| C. | 降低了反应所需的活化能 | |
| D. | 酶具有高度的催化活性和专一性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何一个氧化还原反应都可以设计为原电池,输出电能 | |
| B. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率越大 | |
| D. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
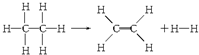
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
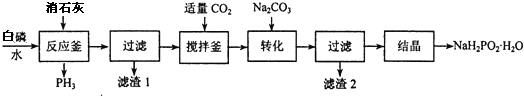
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B也可在O2作用下直接转化为D | |
| B. | 当X是强酸时,A可能是Na2S,F是H2SO4 | |
| C. | 当X是强碱时,过量的B与Cl2发生的反应为:3Cl2+2NH3═N2+6HCl | |
| D. | 无论X是强酸还是强碱,在一定条件下,B和D都能相互反应生成C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | X>Z>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
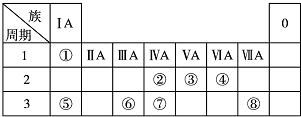
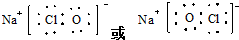 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com