
(1)中学教材中图示了NaCl晶体,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近的O2-核间距离为a×10-8cm,计算NiO晶体的密度。(已知NiO的摩尔质量为74.7 g·mol-1)

(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物Ni和O的比值却发生了变化。某氧化镍样品的组成为Ni0.97O,试计算晶体中Ni3+与Ni2+的离子个数之比。
解析 (1)由题中信息,NiO的晶体结构与NaCl的晶体结构相同,可知一个NiO晶胞中含有4个NiO,计算出一个晶胞的体积,除以4再乘以6.02×1023即得1 mol NiO的体积,再据NiO的摩尔质量即可求得密度。
(2)可根据题意——晶体呈电中性,结合电荷守恒分析:完美NiO晶体中Ni2+与O2-个数比为1:1,在晶体中2个Ni3+代替3个Ni2+时减少1个Ni2+,1 mol有缺陷晶体Ni0.97O中减少0.03 mol Ni2+,则1 mol Ni0.97中含Ni3+为0.06 mol,含Ni2+为0.91 mol,所以Ni3+:Ni2+=6:91。
答案 (1)设取1 mol NiO,质量为74.7 g,再求1 mol NiO的体积为:
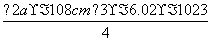 =1.204 a3cm3
=1.204 a3cm3
ρ=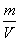 =
=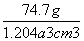 ≈
≈ g·cm-3
g·cm-3
(2)6:91


科目:高中化学 来源: 题型:
下列有关实验操作错误的是()
A. 用药匙取用粉末状或颗粒状固体
B. 用胶头滴管滴加少量液体
C. 倾倒液体时试剂瓶标签面向手心
D. 给盛有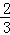 体积液体的试管加热
体积液体的试管加热
查看答案和解析>>
科目:高中化学 来源: 题型:
已知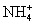 +
+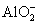 +2H2O====Al(OH)3↓+NH3·H2O,向含有等物质的量的
+2H2O====Al(OH)3↓+NH3·H2O,向含有等物质的量的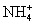 、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
A.H++OH-====H2O
B.Al3++3OH-====Al(OH)3↓
C.Al(OH)3+OH-====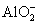 +2H2O
+2H2O
D. 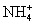 +OH-====NH3·H2O
+OH-====NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固体X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体和非晶体的说法中正确的是( )
A.具有规则几何外形的固体均为晶体
B.晶体具有自范性,非晶体没有自范性
C.晶体研碎后即变为非晶体
D.将玻璃加工成规则的固体即变成晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1,推测含1mol HCl的稀溶液与含1mol NH3的稀溶液反应放出的热量( )
|
| A. | 小于57.3 kJ | B. | 等于57.3 kJ | C. | 大于57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )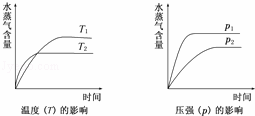
|
| A. | CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
|
| B. | CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
|
| C. | CH3CH2OH(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
|
| D. | 2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH═CH2(g)+2H2O(g);△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g•cm﹣3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
紫菜→(焙烧)→(浸取) (操作①)
(操作①) (操作②)→(蒸馏)→粗产品
(操作②)→(蒸馏)→粗产品
(1)实验室中焙烧紫菜用到的仪器有 .
A.烧杯 B.蒸发皿 C.坩埚 D.试管 E.酒精灯 F.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式 .
(3)操作①的名称是 ;试剂A为 (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
Ⅰ ;
Ⅱ .
(4)操作②应在 (仪器名称)中振荡、静置,操作时先分离出的是 .
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离: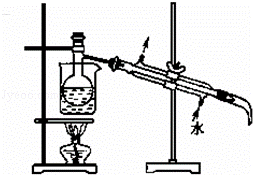
查看答案和解析>>
科目:高中化学 来源: 题型:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)利用反应6NO2+8NH3 7N2+12H2O处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
7N2+12H2O处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
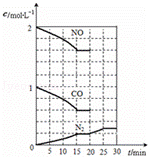
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g);△H<0.该反应的化学平衡常数表达式为K= 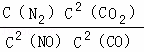 ,该反应△S 0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
,该反应△S 0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42﹣而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com