
ЎѕМвДїЎїМъКЗИЛМеІ»їЙИ±ЙЩµДОўБїФЄЛШЈ¬БтЛбСЗМъѕ§Ме(FeSO4Ў¤7H2O)ФЪТЅБЖЙПіЈУГЧчІ№СЄјБЎЈДіїОНв»о¶ЇРЎЧйОЄІв¶ЁёГІ№СЄјБЦРМъФЄЛШµДє¬БїЈ¬ЙијЖИзПВКµСйЎЈ
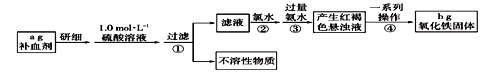
(1)КµСйК±УГ18.4 molЎ¤L-1µДЕЁБтЛбЕдЦЖ100mL1.0 molЎ¤L-1µДБтЛбИЬТєЈ¬ЛщРиЕЁБтЛбµДМе»эОЄ______mLЈЁ±ЈБфТ»О»РЎКэЈ©ЎЈ
(2)ІЅЦиўЩ№эВЛєуµДВЛТєЦРјУИлВИЛ®єу·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄ__________________________ЎЈ
(3)ПтВЛТєЦРЦ±ЅУјУИл№эБї°±Л®К±Ј¬ЙъіЙµД°ЧЙ«іБµнСёЛЩ±дОЄ»ТВМЙ«Ј¬Чоєу±дОЄємєЦЙ«Ј¬іБµнСХЙ«±д»ЇµДФТтУГ»ЇС§·ЅіМКЅ±нКѕОЄ_______________________ЎЈ
(4)ёГІ№СЄјБЦРМъФЄЛШµДЦКБї·ЦКэОЄ____________Ј¬ИфІЅЦиўЫјУИл°±Л®µДБїІ»ЧгЈ¬ФтКµСйЅб№ы_____ЈЁМоЎ°Ж«ґуЎ±ЎўЎ°Ж«РЎЎ±ЎўЎ°ОЮУ°ПмЎ±Ј©
(5)їЖС§СРѕї±нГч·юУГє¬БтЛбСЗМъµДІ№СЄјБК±Ј¬Н¬К±·юУГО¬ЙъЛШCУРАыУЪМъФЄЛШµДОьКХЎЈФтО¬ЙъЛШCФЪЖд№эіМЦРµДЧчУГКЗ_________________ЎЈ
Ўѕґр°ёЎї5.4 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ![]() ЎБ100% Ж«РЎ »№ФјБ
ЎБ100% Ж«РЎ »№ФјБ
ЎѕЅвОцЎї
УЙБчіМНјїЙЦЄЈ¬ёГКµСйФАнОЄЈєЅ«Т©Ж·ЦРµДFe2+РОіЙИЬТєЈ¬Ѕ«Fe2+Сх»ЇОЄFe3+Ј¬К№Fe3+ЧЄ»ЇОЄЗвСх»ЇМъіБµнЈ¬ФЩЧЄ»ЇОЄСх»ЇМъЈ¬НЁ№эІв¶ЁСх»ЇМъµДЦКБїЈ¬јЖЛгІ№СЄјБЦРМъФЄЛШµДє¬БїЈ¬
(1)ёщѕЭЕЁБтЛбФЪПЎКНЗ°єуЈ¬ИЬЦКµДОпЦКµДБї±ЈіЦІ»±дБРКЅјЖЛгЈ»
(2)№эБїВИЛ®Сх»ЇСЗМъАлЧУОЄМъАлЧУЈ»
(3)ПтВЛТєЦРЦ±ЅУјУИл№эБї°±Л®К±Ј¬ЙъіЙµД°ЧЙ«іБµнСёЛЩ±діЙ»ТВМЙ«Ј¬Чоєу±діЙємєЦЙ«Ј¬іБµнСХЙ«±д»ЇКЗЗвСх»ЇСЗМъ±»їХЖшЦРСхЖшСх»ЇЙъіЙЗвСх»ЇМъµД№эіМЈ»
(4)МъФЄЛШКШєг·ЦОцјЖЛгЈ¬ИфІЅЦиўЫјУИл°±Л®µДБїІ»ЧгЈ¬МъАлЧУІ»ДЬИ«ІїіБµнЈ¬Ів¶ЁМъФЄЛШє¬БїЖ«РЎЈ»
(5)·юУГО¬ЙъЛШCЈ¬їЙК№КіОпЦРµДМъАлЧУ»№ФіЙСЗМъАлЧУЈ¬УРАыУЪИЛМеОьКХЎЈ
(1)ЕЁБтЛбФЪПЎКНЗ°єуЈ¬ИЬЦКµДОпЦКµДБї±ЈіЦІ»±дЈ¬ЙиЛщРиЕЁБтЛбМе»эОЄVЈ¬Фт100mLЎБ10-3ЎБ1mol/L=18.4mol/LЎБVЈ¬ЅвµГV=5.4mLЈ»
(2)ІЅЦиўЩ№эВЛєуЛщµГВЛТєЦРјУИл№эБїВИЛ®Ј¬КЗОЄБЛСх»ЇFe2+Ј¬·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄЈє2Fe2++Cl2=2Fe3++2Cl-Ј»
(3)ПтВЛТєЦРЦ±ЅУјУИл№эБї°±Л®К±Ј¬ЙъіЙµД°ЧЙ«іБµнСёЛЩ±діЙ»ТВМЙ«Ј¬Чоєу±діЙємєЦЙ«Ј¬іБµнСХЙ«±д»ЇµД»ЇС§·ЅіМКЅЈє4Fe(OH)2+O2+2H2O=4Fe(OH)3Ј»
(4)БчіМ·ЦОцїЙЦЄЧоєуµГµЅСх»ЇМъЦКБїОЄbgЈ¬ТАѕЭМъФЄЛШКШєгµГµЅМъµДЦКБї·ЦКэ=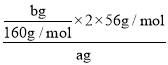 ЎБ100%=
ЎБ100%=![]() %Ј»ИфІЅЦиўЫјУИл°±Л®µДБїІ»ЧгЈ¬МъАлЧУІ»ДЬИ«ІїРОіЙіБµнЈ¬ФтІв¶ЁМъФЄЛШЦКБї·ЦКэЖ«РЎЈ»
%Ј»ИфІЅЦиўЫјУИл°±Л®µДБїІ»ЧгЈ¬МъАлЧУІ»ДЬИ«ІїРОіЙіБµнЈ¬ФтІв¶ЁМъФЄЛШЦКБї·ЦКэЖ«РЎЈ»
(5)О¬ЙъЛШCУР»№ФРФЈ¬ДЬ·юУГО¬ЙъЛШCЈ¬їЙК№КіОпЦРµДМъАлЧУ»№ФіЙСЗМъАлЧУЈ¬УРАыУЪИЛМеОьКХЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїёхОЄёЯР§ґЯ»ЇјБµДЦчТЄіЙ·ЦФЄЛШЈ¬ґУёхМъїу[ЦчТЄє¬Ag2SЎўCu2(OH)2CO3ЎўFeOЎўCr2O3ЎўSiO2]ЦРМбИЎCrЎўAgµД№¤ТХБчіМИзНјЈє
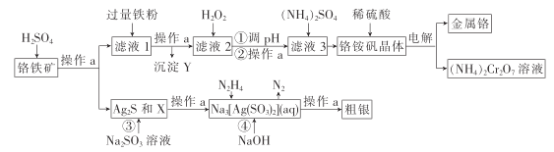
ТСЦЄЈєўЩІї·ЦСфАлЧУТФЗвСх»ЇОпїЄКјіБµнєННкИ«іБµнµДpHИзПВ±н(ЅрКфАлЧУЕЁ¶ИОЄ0.01molЎ¤L-1)
іБµнОп | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
їЄКјіБµнµДpH | 7.6 | 2.7 | 4.9 |
їЄКјіБµнµДpH | 9.6 | 3.7 | 6.8 |
ўЪёхп§·Їѕ§МеЈє[NH4Cr(SO4)2Ў¤12H2O]
ЈЁ1Ј©ІЩЧчaОЄ___Ј»XєНY·Ц±рОЄ____Ўў___ЎЈ
ЈЁ2Ј©РґіцјУИлH2O2·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅЈє___ЎЈ
ЈЁ3Ј©µчЅЪpHЦµїЙУГµДОпЦКµД»ЇС§КЅОЄ___Ј¬pHЦµУ¦µ±їШЦЖµД·¶О§ОЄ__Ј»УЙВЛТє3»сµГёхЛбп§ѕ§МеµДХэИ·ІЩЧч·Ѕ·ЁКЗ___Ўў№эВЛЎўПґµУЎўёЙФпЎЈ
ЈЁ4Ј©Ѕ«ёхп§·Їѕ§МеИЬУЪБтЛб¶шІ»КЗЦ±ЅУИЬУЪЛ®µДЦчТЄФТтКЗ___ЎЈ
ЈЁ5Ј©ІЅЦиўЬ·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄ___ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіЦЦИЫИЪМјЛбСОИјБПµзіШТФLi2CO3ЎўK2CO3ОЄµзЅвЦКЎўТФCH4ОЄИјБПК±Ј¬ёГµзіШ№¤ЧчФАнИзНјЈ¬ПВБРЛµ·ЁХэИ·µДКЗ (ЎЎЎЎ)ЎЈ

A. aОЄCH4Ј¬bОЄCO2
B. ![]() Птёєј«ТЖ¶Ї
Птёєј«ТЖ¶Ї
C. ґЛµзіШФЪіЈОВК±ТІДЬ№¤Чч
D. Хэј«µзј«·ґУ¦КЅОЄO2Ј«2CO2Ј«4eЈ===2![]()
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄід·ЦИјЙХa gТТИІЖшМеК±ЙъіЙ1 mol¶юСх»ЇМјЖшМеєНТєМ¬Л®Ј¬Іў·ЕіцИИБїb kJЈ¬ФтТТИІИјЙХµДИИ»ЇС§·ЅіМКЅХэИ·µДКЗ
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)Ј»ЎчH=+b kJ/mol
B. C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l)Ј»ЎчH=+2b kJ/mol
O2(g)=2CO2(g)+H2O(l)Ј»ЎчH=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)Ј»ЎчH=Ј2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)Ј»ЎчH=Ј4b kJ/mol
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї¶юСх»ЇВИ(C1O2)КЗТЧИЬУЪЛ®ЗТІ»УлЛ®·ґУ¦µД»ЖВМЙ«ЖшМеЈ¬·РµгОЄ11ЎжЎЈДіРЎЧйФЪКµСйКТЦРЦЖ±ёC1O2µДЧ°ЦГИзПВЈє[ТСЦЄЈєSO2+2NaC1O3+H2SO4=2C1O2+2NaHSO4]
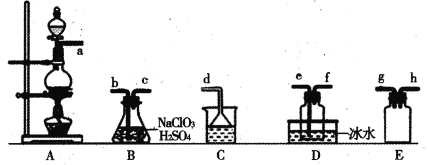
ПВБРЛµ·ЁХэИ·µДКЗ
A.Б¬ЅУЧ°ЦГК±Ј¬µј№ЬїЪaУ¦ЅУh»тgЈ¬µј№ЬїЪcУ¦ЅУe
B.Ч°ЦГCЦРЧ°µДКЗ±ҐєНКіСОЛ®Ј¬µј№ЬїЪaНЁ№эµДЖшМеОЄSO2
C.Ч°ЦГD·Е±щЛ®µДДїµДКЗТє»ЇSO2Ј¬·АЦ№ОЫИѕ»·ѕі
D.їЙСЎУГЧ°ЦГAЈ¬УГ1 molЎ¤L-1СОЛбУлMnO2·ґУ¦ЦЖИЎCl2
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБР№ШУЪКµСйКТЦЖВИЖшµДЛµ·ЁЦРґнОуµДКЗЈЁ Ј©
A.ёГ·ґУ¦КЗТ»ёцСх»Ї»№Ф·ґУ¦Ј¬ЖдЦР¶юСх»ЇГМКЗСх»ЇјБ
B.ГїЙъіЙ1molВИЖшЈ¬ѕНТЄЧЄТЖ2molµзЧУ
C.ёГ·ґУ¦µДАлЧУ·ЅіМКЅОЄMnO2Ј«4HЈ«Ј«4ClЈ![]() MnCl2Ј«2H2OЈ«Cl2Ўь
MnCl2Ј«2H2OЈ«Cl2Ўь
D.ёГ·Ѕ·ЁКЗИрµд»ЇС§јТЙбАХЧоПИ·ўПЦµД
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЈЁ1Ј©ёщѕЭИзНјЛщКѕЗйїцЈ¬ЕР¶ППВБРЛµ·ЁЦРХэИ·µДКЗ____ЎЈ
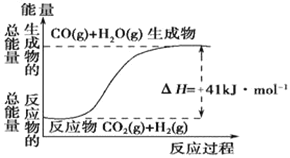
AЈ®ЖдИИ»ЇС§·ЅіМКЅОЄЈєCO(g)+H2O(g)=CO2(g)+H2(g) ЎчH=41kJmol©Ѓ1
BЈ®ёГ·ґУ¦ОЄОьИИ·ґУ¦
CЈ®ёГ·ґУ¦ОЄ·ЕИИ·ґУ¦
DЈ®Ифµ±H2OОЄТєМ¬К±·ґУ¦ИИОЄЎчH2Ј¬ФтЎчH2ЈѕЎчH
ЈЁ2Ј©25ЎжЎў101kPaПВЈ¬ТСЦЄ1gЗвЖшНкИ«ИјЙХЙъіЙТєМ¬Л®К±·Еіц142.9kJµДИИБїЈ¬±нКѕЗвЖшИјЙХИИµДИИ»ЇС§·ЅіМКЅКЗ_____ЎЈ
ЈЁ3Ј©ТСЦЄ·ґУ¦ЈєN2(g)+O2(g)=2NO(g) ЎчH1
2H2(g)+O2(g)=2H2O(g) ЎчH2
N2(g)+3H2(g)=2NH3(g) ЎчH3
АыУГЙПКцИэёц·ґУ¦Ј¬јЖЛг4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ЎчH4 µД·ґУ¦мК±дОЄЈє__ЈЁУГє¬ЎчH1ЎўЎчH2ЎўЎчH3µДКЅЧУ±нКѕЈ©ЎЈ
ЈЁ4Ј©ТСЦЄ·ґУ¦2HI(g)H2(g)+I2(g)µДЎчH=+11kJmol©Ѓ1Ј¬1molH2(g)Ўў1molI2(g)·ЦЧУЦР»ЇС§јь¶ПБСК±·Ц±рРиТЄОьКХ436kJЎў151kJµДДЬБїЈ¬Фт1molHI(g)·ЦЧУЦР»ЇС§јь¶ПБСК±РиОьКХµДДЬБїОЄ___kJЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї°±єНПхЛб¶јКЗЦШТЄµД№¤ТµФБПЎЈ
ЈЁ1Ј©±кЧјЧґїцПВЈ¬Ѕ«500 L°±ЖшИЬУЪЛ®РОіЙ1 L°±Л®Ј¬ФтґЛ°±Л®µДОпЦКµДБїЕЁ¶ИОЄ__molЎ¤ L-1ЈЁ±ЈБфИэО»УРР§КэЧЦЈ©ЎЈ№¤ТµЙПіЈУГ№эБї°±Л®ОьКХ¶юСх»ЇБтЈ¬ёГ·ґУ¦µД»ЇС§·ЅіМКЅОЄ__ЎЈ
ЈЁ2Ј©°±Сх»Ї·ЁКЗ№¤ТµЙъІъЦРєПіЙПхЛбµДЦчТЄНѕѕ¶ЎЈєПіЙµДµЪТ»ІЅКЗЅ«°±єНїХЖшµД»мєПЖшНЁ№эЧЖИИµДІ¬ооєПЅрНшЈ¬ФЪєПЅрНшµДґЯ»ЇПВЈ¬°±±»Сх»ЇіЙТ»Сх»ЇµЄЈ¬ёГ·ґУ¦µД»ЇС§·ЅіМКЅОЄ__ЎЈ
ПВБР·ґУ¦ЦРµД°±Ул°±Сх»Ї·ЁЦРµД°±ЧчУГПаН¬µДКЗ__ЎЈ
AЈ®2Na+2NH3===2NaNH2+H2Ўь BЈ®2NH3+3CuO===3Cu+N2+3H2O
CЈ®4NH3+6NO===5N2+6H2O DЈ®HNO3+NH3===NH4NO3
№¤ТµЦРµДОІЖшЈЁјЩЙиЦ»УРNOєНNO2Ј©УГЙХјоЅшРРОьКХЈ¬·ґУ¦µДАлЧУ·ЅіМКЅОЄ2NO2+2OH©Ѓ===NO2-+NO3-+H2OєНNO+NO2+2OH©Ѓ===ЎхЎЎЎЎ+H2OЈЁЕдЖЅёГ·ЅіМКЅЈ©ЎЈ______________
ЈЁ3Ј©Пт27.2 g CuєНCu2OµД»мєПОпЦРјУИлДіЕЁ¶ИµДПЎHNO3500 mLЈ¬·ґУ¦№эіМЦРІъЙъµДЖшМеЦ»УРNOЎЈ№ММеНкИ«ИЬЅвєуЈ¬ФЪЛщµГИЬТєЈЁЅрКфСфАлЧУЦ»УРCu2+Ј©ЦРјУИл1 L 1 molЎ¤L-1µДNaOHИЬТєК№ЅрКфАлЧУЗЎєГНкИ«іБµнЈ¬ґЛК±ИЬТєіКЦРРФЈ¬ЛщµГіБµнЦКБїОЄ39.2 gЎЈ
ўЩCuУлПЎHNO3·ґУ¦µДАлЧУ·ЅіМКЅОЄ__ЎЈ
ўЪCuУлCu2O µДОпЦКµДБїЦ®±ИОЄ__ЎЈ
ўЫHNO3µДОпЦКµДБїЕЁ¶ИОЄ__molЎ¤L-1ЎЈ
ЈЁ4Ј©УРH2SO4єНHNO3µД»мєПИЬТє20 mLЈ¬јУИл0.25 molL©Ѓ1BaЈЁOHЈ©2ИЬТєК±Ј¬ЙъіЙіБµнµДЦКБїwЈЁgЈ©єНBaЈЁOHЈ©2ИЬТєµДМе»эVЈЁmLЈ©µД№ШПµИзНјЛщКѕЈЁC µг»мєПТєіКЦРРФЈ©ЎЈФтФ»мєПТєЦРH2SO4µДОпЦКµДБїЕЁ¶ИОЄ__molЎ¤L-1Ј¬HNO3µДОпЦКµДБїЕЁ¶ИОЄ__molЎ¤L-1ЎЈ

Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїAlNѕЯУРДНёЯОВЎўµјИИРФєГµИУЕµгЈ¬їЙИЬУЪЕЁµДNaOHИЬТєЎЈТ»¶ЁМхјюПВїЙНЁ№э·ґУ¦Al2O3+N2+3CЈЅ2AlN+3COєПіЙЎЈПВБРРрКцХэИ·µДКЗЈЁ Ј©
A.·ґУ¦ЦРN2КЗ»№ФјБ
B.AlNїЙЧчДНёЯОВІДБП
C.ГїЙъіЙ1 mol AlNЈ¬УР3molµзЧУЧЄТЖ
D.ІъОпAlNЦР»мУРµДAl2O3їЙУГЕЁµДNaOHИЬТєіэИҐ
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com