
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2 NA? | |
| B. | 常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为8NA | |
| D. | 25℃时,l L pH=13的Ba(OH)2溶液中含有的OH- 数为0.2 NA |
分析 A、偏铝酸钠溶液中,除了偏铝酸钠外,水中也含氧原子;
B、碳酸钠由2个钠离子和1个过氧根构成;
C、求出18O2的物质的量,然后根据18O2中含20个中子来分析;
D、pH=13的Ba(OH)2溶液中氢氧根的浓度为0.1mol/L.
解答 解:A、偏铝酸钠溶液中,除了偏铝酸钠外,水中也含氧原子,故溶液中含有的氧原子的个数大于2NA个,故A错误;
B、碳酸钠由2个钠离子和1个过氧根构成,故0.1mol碳酸钠中含0.1mol碳酸根即0.1NA个,故B正确;
C、标况下11.2L18O2的物质的量为0.5mol,而18O2中含20个中子,故0.5mol中含10mol中子即10NA个,故C错误;
D、pH=13的Ba(OH)2溶液中氢氧根的浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:解答题
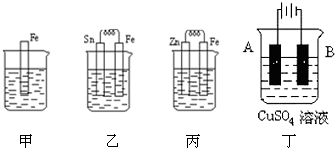
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
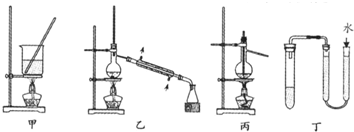
| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 同温同压下,两种气体的体积之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的密度之比为17:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种.
有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种. 最合理的方案.
最合理的方案.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-3e一═Fe3+ | B. | Fe2+十20H-═Fe(OH)2 | ||
| C. | 2H20+02+4e-═40H- | D. | 4Fe(OH)2+2H20+02═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
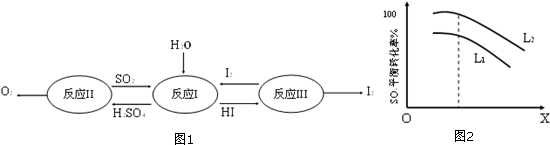
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com