
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
分析 根据结晶水合物的相对分子质量和质量可求解物质的量,根据C=$\frac{n}{V}$、质量分数=$\frac{溶质质量}{溶液质量}$×100%、
溶解度等于100g水中溶解溶质的质量、ρ=$\frac{m}{V}$进行有关计算.
解答 解:A.溶液的质量=(a+b)g,溶液的密度=$\frac{a+b}{V}$,故A正确;
B.溶质的物质的量=$\frac{a}{M}$,溶液的物质的量浓度=$\frac{\frac{a}{M}mol}{V×1{0}^{-3}L}$=$\frac{1{0}^{3}a}{MV}$,故B错误;
C.溶质的质量=a×$\frac{M-18n}{M}$=$\frac{a(M-18n)}{M}$g,溶剂的质量=$\frac{18na}{M}$+bg,所以其溶解度=$\frac{100×\frac{a(M-18n)}{M}}{\frac{18an}{M}+b}$=$\frac{100a(M-18n)}{18an+Mb}$g,故C正确;
D.溶质的质量=a×$\frac{M-18n}{M}$=$\frac{a(M-18n)}{M}$g,所以饱和溶液的质量分数=$\frac{\frac{a(M-18n)}{M}}{a+b}$×100%=$\frac{a(M-18n)}{M(a+b)}$×100%,故D正确;
故选B.
点评 本题考查物质的有关计算,明确公式表达式是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 相同质量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L N2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2gH2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子22.4L | |
| D. | 1L含NA个NH3•H2O的氨水,其浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
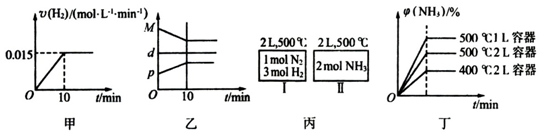
| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
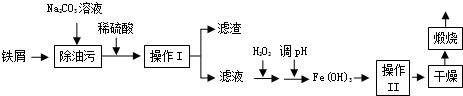
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 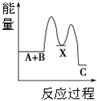 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 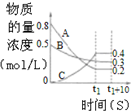 图表示反应的化学方程式为3A+B═2C | |
| C. | 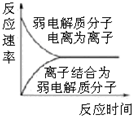 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 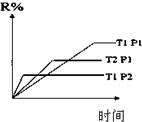 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com