
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成分是下列物质中的一种,这种物质是
A.NaClO B.NaOH C.KMnO4 D.Na2O2
科目:高中化学 来源:2017届江西省高三上学期10月月考化学试卷(解析版) 题型:选择题
已知:SO+Br2+H2O→SO+2Br-+2H+。某溶液中可能含有Na+、NH、Fe2+、K+、Br-、SO、SO,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含Br- B.无法确定SO是否存在
C.肯定含有Na+ D.肯定含有SO
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上第三次月考化学试卷(解析版) 题型:填空题
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:

①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a. 容器中的压强不变 b.气体的密度不再改变
c. v正(CO2)=v逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上10月月考化学卷(解析版) 题型:选择题
下列溶液中,与100mL0.5mol/LNaCl溶液所含Cl-物质的量浓度相同的是
A.100mL0.5mol/LMgCl2溶液
B.200mL0.25mol/LCaCl2溶液
C.50mL1mol/LNaCl溶液
D.25mL0.6mol/LHCl溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上10月月考化学卷(解析版) 题型:选择题
①过滤②蒸发③溶解④向容量瓶中转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上10月月考化学卷(解析版) 题型:选择题
如图所示的实验操作中,正确的是


A. 摇匀 B. 给溶液加热 C. 滴加液体 D. 过滤
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次月考化学试卷(解析版) 题型:实验题
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置,其中D装置试管内盛有水,烧杯内为沸水浴。
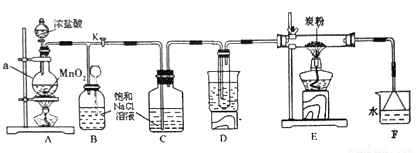
(1)仪器a的名称是 。
(2)C装置的作用是 。
(3)E装置中发生氧化还原反应,生成CO2和HCl(g).写出发生反应的化学方程式 。D装置的作用是 。
(4)E处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有Cl2产生,B中的现象是 。
(5)量取20mlF装置中溶液,倒入分液漏斗中,然后再注入10mlCCl4,盖好玻璃塞,振荡,静置、分层后分别取上层液和下层液进行试验,其中能使有色布条褪色的是 (填“上层液”或“下层液”)。
(6)设计试验方案证明上述试验E中反应有HCl(g)生成 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次考试化学试卷(解析版) 题型:实验题
氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
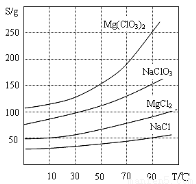
(1)过滤所需要的主要玻璃仪器有 。
(2)加MgO后过滤所得滤渣的主要成分的化学式为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;② ;洗涤;
③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
① 写出步骤2中发生反应的离子方程式 ;
② 产品中Mg(ClO3)2·6H2O的质量分数为 。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上第一次月考化学卷(解析版) 题型:选择题
下列各组物质中,所含氧原子的物质的量相同的是
A.0.3 mol O2和0.3 mol H2O
B.0.1mol H2SO4和 3.6 g H2O
C.0.1mol MgSO4•7 H2O和 0.1mol C12H22O11(蔗糖)
D.6.02X1022个 CO2与0.1mol KMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com