
【题目】下列操作或试剂的选择合理的是( )
A.焰色反应时需用稀硫酸洗净铂丝,并在火焰上灼烧至无色。
B.用湿润的pH试纸测得某碱性溶液的pH为13
C.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
D.用丁达尔效应可鉴别![]() 溶液和
溶液和![]() 胶体
胶体
科目:高中化学 来源: 题型:
【题目】某废渣中含有Al 2O3和Cr2O3(三氧化二铬),再次回收利用工艺流程如下。

回答下列问题:
(1)滤液1中阴离子为CrO42-和AlO2-,X的电子式是_______。写出滤液1与过量气体X反应生成Al(OH) 3的离子方程式:_____________________。
(2)“熔烧”中反应之一是4Na2CO3+ 2Cr2O3+ 3O2 =4Na2CrO4+ 4X,该反应中被氧化的物质是______(填化学式);若该反应转移6mol电子,则生成_____mol Na2CrO4。
(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。写出离子方程式____________。
(4)已知该废料中含铬元素质量分数为a%,wt这样废料经上述流程提取mkgCr2O3。则该废料中铬元素回收率为_______(用代数式表示)。(已知回收率等于实际回收质量与理论质量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为__。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为__。
(3)![]() 的沸点比
的沸点比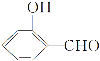 高,原因是___。
高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
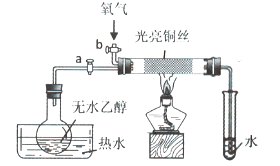
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),得出的相关数据如表所示:
2SO3(g),得出的相关数据如表所示:
时间/min | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
0 | 0.200 | 0.100 | 0 |
10 | 0.190 | 0.095 | 0.010 |
15 | 0.160 | 0.080 | 0.040 |
20 | 0.160 | 0.080 | 0.040 |
25 | 0.150 | 0.150 | 0.050 |
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:酸式乙二酸钠与浓硫酸共热时反应为![]() 。利用该反应所产生的气体(X)用有关仪器装置进行实验:
。利用该反应所产生的气体(X)用有关仪器装置进行实验:
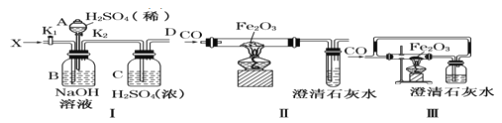
下列说法不正确的是( )
A.对I装置,活塞![]() 关闭,打开活塞
关闭,打开活塞![]() ,在导管D处能得到纯净而干燥的CO
,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞![]() ,打开活塞
,打开活塞![]() ,在导管D处得到纯净而干燥的
,在导管D处得到纯净而干燥的![]()
C.利用装置I中D处所得纯净CO气体,通过实验装置II能够说明CO具有还原性
D.实验装置III与实验装置II相比较,能减少CO污染,能顺利完成氧化铁还原实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
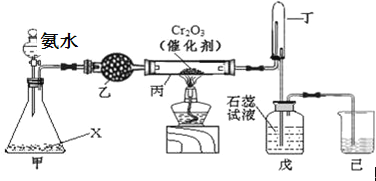
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com