
| A. | 加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(Cl{O}^{-})}$增大 | |
| B. | 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+) | |
| C. | 溶液中2c(Ca2+)+c(H+)=c(ClO-)+c(OH-) | |
| D. | 若溶液的pH=l2,则c(ClO-)的水解百分率约为9.1% |
分析 A.Ca(ClO)2溶液中存在弱电解质酸根离子ClO-的水解平衡,离子浓度越稀,水解程度越大;
B.根据酸根离子ClO-水解平衡、水的电离平衡进行分析;
C.任何电解质溶液中都存在电荷守恒,溶液中存在ClO-、OH-、Ca2+、H+;
D.根据ClO-的水解百分率=$\frac{已经发生水解的次氯酸根离子}{次氯酸根离子的初始浓度}$×100%.
解答 解:A.Ca(ClO)2溶液中弱电解质酸根离子ClO-水解:ClO-+H2O?HClO+OH-,离子浓度越稀,水解程度越大,稀释水解平衡向右移动,n(ClO-)减小,而n(OH-)增大,故$\frac{c(O{H}^{-})}{c(Cl{O}^{-})}$增大,故A正确;
B.Ca(ClO)2溶液中存在ClO-水解平衡:ClO-+H2O?HClO+OH-,所以c(OH-)>c(H+),存在水的电离平衡:H2O?H++OH-,所以c(OH-)>c(HClO),故B错误;
C.溶液中存在电荷守恒,阳离子所带的正电荷总数等于负电荷所带的负电荷总数,即2c(Ca2+)+c(H+)=c(ClO-)+c(OH-),故C正确;
D.若溶液的pH=l2,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$=0.01mol/L,ClO-+H2O?HClO+OH-,参加水解的ClO-为0.01mol/L,室温下,测得Ca(ClO)2溶液中c(ClO-)=0.1mol/L,则原始浓度为:(0.01+0.1)=0.11mol/L,则c(ClO-)的水解百分率约为$\frac{0.01}{0.11}$×100%≈9.1%,故D正确;
故选B.
点评 本题考查盐类水解、弱电解质的电离等,注意灵活应用水解平衡、电荷守恒,题目难度中等.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是研究确定有机物成分的有效方法 | |
| C. | 1H核磁共振谱通常用于分析有机物的相对分子质量 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
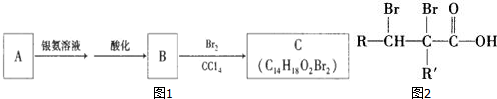 有机物A为茉莉香型香料.
有机物A为茉莉香型香料.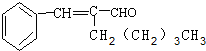 .
.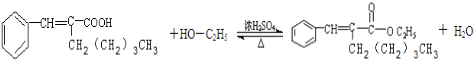 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 偏二甲肼既是氧化剂又是还原剂 | |
| B. | 该反应进行时只有放热过程没有吸热过程 | |
| C. | 该反应中氮元素的化合价升高 | |
| D. | 该反应中每生成1mol CO2转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
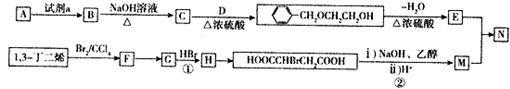
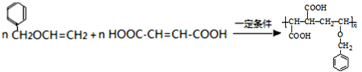 .
.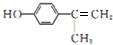 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
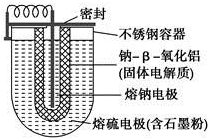 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com