
【题目】某学习小组设计实验探究H2S的性质。实验室用硫化亚铁(难溶,块状)与盐酸反应制备硫化氢。他们设计装置如图所示。

回答下列问题:
(1)停止A中反应的操作是________________。
(2)试制X可能是______(填代号)。
(a)氢氧化钠溶液 (b)硝酸 (c)饱和NaHS溶液 (d)氯化铁溶液
(3)写出A中发生反应的离子方程式:_________________。
(4)若E中产生浅黄色沉淀,则氧化性:Cl2____ S(填“>”“<”或“==”)。
(5)若观察到D中紫红色溶液变为无色溶液,则表明H2S具有的性质有_____(填代号)。
(a)酸性 (b)氧化性 (c)不稳定性 (d)还原性
(6)为了证明F中有Fe2+生成,取少量F中溶液于试管,微热溶液,冷却,向试管中滴加下列试剂中的____。(填代号)
①KSCN 溶液 ②酸化的双氧水 ③酸性高锰酸钾溶液 ④氢氧化钠溶液
【答案】关闭K活塞 c FeS+2H+=Fe2++H2S↑ > d ③
【解析】
(1)要停止A中反应的操作是关闭K活塞;(2)试制X是为了除去挥发出来的HCl,又要不与H2S反应,(a)氢氧化钠溶液能吸收H2S,故错误;(b)硝酸能将H2S氧化,故错误; (c)饱和NaHS溶液能吸收HCl,又不与H2S反应,故正确;(d)氯化铁溶液能将H2S氧化,故错误;故选C。(3)A中制取H2S的离子方程式:FeS+2H+=Fe2++H2S↑;(4)若E中产生浅黄色沉淀,发生H2S+Cl2=2HCl+S↓,反应中氧化剂的氧化性大于氧化产物:Cl2> S;(5)若观察到D中紫红色溶液变为无色溶液,则表明H2S具有的性质有还原性,5H2S+8MnO4-+16H+=8Mn2++5SO42-+13H2O故选d;(6)2Fe3++H2S=2Fe2++S↓+2H+,溶液中存在Fe2+,取少量F中溶液于试管,微热溶液,冷却,向试管中滴加下列试剂中的酸性高锰酸钾溶液,紫红色褪去,故选③。


科目:高中化学 来源: 题型:
【题目】在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol/L、0.15mol/L,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是
A. 0.15mol/L B. 0.225mol/L C. 0.30mol/L D. 0.45mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
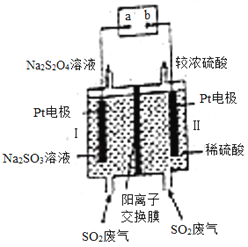
A. 电极Ⅱ为阳极,发生还原反应
B. 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大
C. 阴极区电极反应式为:2SO2+2e﹣═S2O42﹣
D. 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
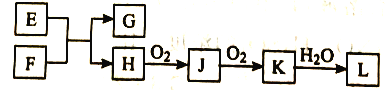
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如图所示。
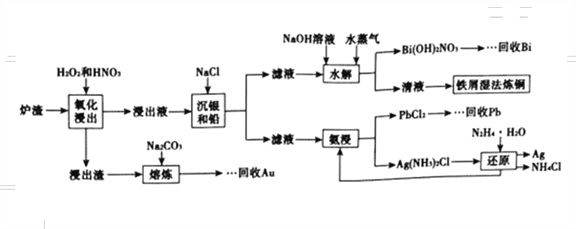
回答下列问题:
(1)氧化浸取时加入H2O2的目的是__________________________(只要回答出一点即可)。
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是_____________________________。
(3)加入NaOH溶液的目的是调节溶液的pH,水解时通入水蒸气的目的是_______________________。
(4)流程中加入N2H4·H2O还原得到银的化学方程式是_____________________________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________mol·L-1。
(6)用流程中得到的铅制取Pb(NO3)2。用石墨作电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是_______________________,若电解液中不加入Cu(NO3)2,阴极反应式是______________________,这样做的主要缺点是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医药合成中可用下列流程合成一种治疗心脏病的特效药物(G)。
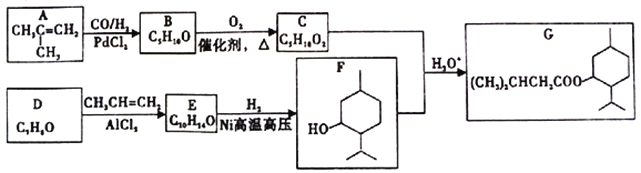
已知:①RCH=CH2![]() RCH2CH2CHO;
RCH2CH2CHO;
②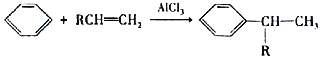
(1)B的核磁共振氢谱图中有_______组吸收峰,C的名称为_________。
(2)E中含氧官能团的名称为_______,写出D→E的化学方程式_______ 。
(3)E-F的反应类型为________ 。
(4)E的同分异构体中,结构中有醚键且苯环上只有一个取代基结构有_____种,写出其中甲基数目最多的同分异构体的结构简式_______ 。
(5)下列有关产物G的说法正确的是__________
A.G的分子式为C15H28O2 B.1molG水解能消耗2molNaOH
C.G中至少有8个C原子共平面 D.合成路线中生成G的反应为取代反应
(6)写出以1-丁醇为原料制备C的同分异构体正戊酸(CH3CH2CH2CH2COOH)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH,无机试剂任选。___________
CH3CH2OH,无机试剂任选。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学可以变废为室,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是
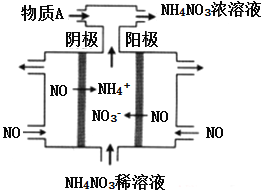
A. 该电解池的阳极反反为:NO-3e-+2H2O=NO3-+4H+
B. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
C. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
D. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com