
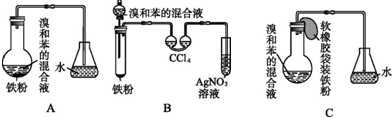
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.
+HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.分析 (1)A、B、C三种装置都可制取溴苯,都会发生铁与溴的反应、苯与溴的取代反应;未被吸收的HBr进入硝酸银溶液,与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀;
(2)苯和溴易挥发,长导管能导气及回流冷凝作用;
(3)根据溴和苯的混合液与铁粉混合才能发生反应;反应需要铁做催化剂,要使反应开始,应向C中加入铁粉;
(4)双球吸收关吸收了溴和苯;反应后双球吸管中四氯化碳吸收了溴;
(5)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低,由于导管插入AgNO3溶液中而容易产生倒吸.
解答 解:(1)A、B、C三种装置都可制取溴苯,三个装置中都发生都会发生铁与溴的反应、苯与溴的取代反应,反应的化学方程式为2Fe+3Br2=2FeBr3, +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;HBr与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀,方程式为:HBr+AgNO3=AgBr↓+HNO3,
+HBr;HBr与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀,方程式为:HBr+AgNO3=AgBr↓+HNO3,
故答案为:2Fe+3Br2=2FeBr3, +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;HBr+AgNO3=AgBr↓+HNO3;
+HBr;HBr+AgNO3=AgBr↓+HNO3;
(2)苯和溴的取代反应中有溴化氢生成,苯和溴易挥发,所以导管b除导气外,还有起冷凝回流作用,减少苯和溴的挥发,
故答案为:导气(导出HBr)兼冷凝(冷凝苯和溴蒸气);
(3)溴和苯的混合液与铁粉混合才能发生反应,故打开分液漏斗活塞,使反应液流下;反应需要铁做催化剂,要使反应开始,应向C中加入铁粉,即托起软橡胶袋使铁粉落入溴和苯组成的混合液中;
故答案为:打开分液漏斗盖子,旋转分液漏斗的活塞,使溴和苯的混合液滴到铁上;托起软橡胶袋使铁粉落入溴和苯组成的混合液中;
(4)B装置中采用了双球吸收管,利用四氯化碳吸收反应中随HBr逸出的溴和苯的蒸气;反应后双球吸管中四氯化碳吸收了溴单质,溶液从无色变成了橙色;
故答案为:吸收反应中随HBr逸出的溴和苯的蒸气;CCl4由无色变橙色;
(5)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行.这两个缺点是:随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;导管插入AgNO3溶液中易产生倒吸(或“气体不流畅”,或“气流过快,将双球管中液体压入右侧试管”等合理答案均可),
故答案为:随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;导管插入AgNO3溶液中易产生倒吸.
点评 本题考查溴苯的制备实验,为高频考点,把握物质的性质、制备原理及实验装置的作用为解答本题的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
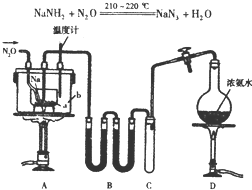 NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z浓度之比为1:2:2 | |
| C. | 容器内气体混合物的压强不随时间变化 | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 .
. +2NaOH→
+2NaOH→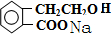 +HCOONa+H2O.
+HCOONa+H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com