
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
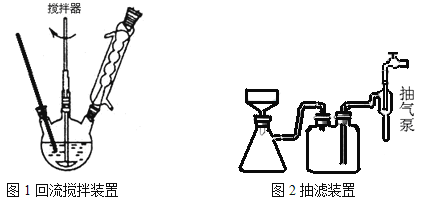
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
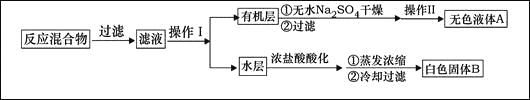
(1)无色液体A的结构简式为 。操作Ⅱspan>为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
【答案】(1)![]() (2分) 蒸馏(2分)
(2分) 蒸馏(2分)
(2)除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气;(2分)
(3)ABD (2分)漏选得一分,错选不得分
(4) NaOH溶液(2分) 浓盐酸酸化(2分) (5) 96% (2分)
【解析】试题分析:(1)结合操作目的,分析流程知:对反应后的溶液过滤除去生成的MnO2,滤液经分液所得有机层含有末反应的甲苯,水层含有生成的苯甲酸钾及其它可溶性物质。有机层经干燥剂干燥、过滤后,再经操作II得到的无色液体A应为甲苯。操作II为蒸馏。(2) 滤液呈紫色,证明高锰酸钾有剩余,又因为高锰酸钾会与浓盐酸反应产生氯气,所以应先加KHSO4除去末反应的高锰酸钾,再加浓盐酸酸化。(3) A、抽滤可以加快过滤速度,得到较干燥的沉淀;故A正确。
B、安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触;故B正确。C、三颈烧瓶不能直接加热;故C不正确。D冷凝管中水的流向应是下进上出。故D正确。(4) 除去残留在苯甲酸中的甲苯时,先加入NaOH溶液,使苯甲酸转化为可溶性的苯甲酸钠溶于水,再经分液操作,将甲苯(有机层)除去,然后用浓盐酸把可溶性的苯甲酸钠转化为苯甲酸。(5) 根据关系式:
![]() --KOH
--KOH
122g 1mol
m 4×2.4×10-3mol
m=122g×4×2.4×10-3mol /1mol= 1.1712g
产品中苯甲酸质量分数为:1.1712g/1.22g×100%=96%


科目:高中化学 来源: 题型:
【题目】某同学欲用物质的量浓度为0.100 0 mol·L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂。请填写下列空白:
(1) 用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液_________________,立即停止滴定。
(2) 下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出

(3) 若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为 mL。若仰视,会使读数偏___________(填“大”或“小”)。
(4) 再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是 mol·L-1。
滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.AgNO3 B.NaCl C.CuCl2 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验装置的说法中正确的是
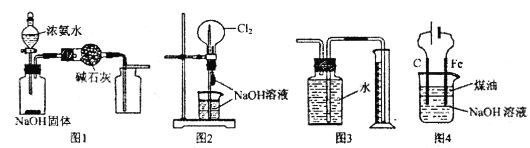
A. 图l装置可制取干燥纯净的NH3
B. 图2装置可以完成“喷泉”实验
C. 图3装置可测量Cu与浓硝酸反应产生气体的体积
D. 图4装置可用于实验室制备Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 0.5mol/L NaOH溶液稀释到500ml,稀释后取出5ml,则溶液中NaOH的物质的量浓度为 ( )
A. 0.03mol/L B. 0.3mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
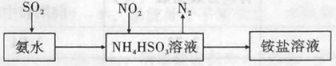
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
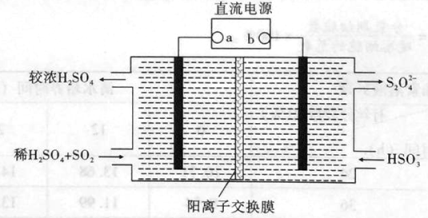
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制高能量电池,已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法
B.热还原法
C.热分解法
D.铅热法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是

A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com