
| c(碱)V(碱) |
| V(酸) |
| c(碱)V(碱) |
| V(酸) |
| c(碱)V(碱) |
| V(酸) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
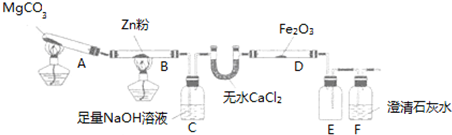
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀硫酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加少量酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 酸性KMnO4溶液褪色 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
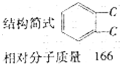 实验室中某试剂瓶的标签严重破损,只能隐约看到如图所示部分:
实验室中某试剂瓶的标签严重破损,只能隐约看到如图所示部分: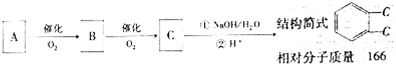
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C、室温下,向0.01mol/LNH4HSO4 溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42->c(NH4+)>c(OH-)=c(H+) |
| D、物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,离子浓度可能的关系为:c(Na+)>c(OH-)>c(HA)>c(HB) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、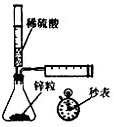 测定一定时间内生成H2的反应速率 |
B、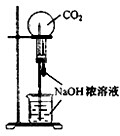 用CO2做喷泉实验 |
C、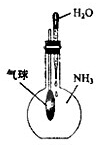 验证NH3易溶于水 |
D、 比较Na2CO3与NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
| B、中和滴定前,用待测液润洗锥形瓶 |
| C、将10g CuSO4?5H2O溶解在90g水中配制10%的CuSO4溶液 |
| D、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 |
| B、8:1 |
| C、35.5:108 |
| D、108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe粉中混有Zn粉杂质(稀H2SO4) |
| B、FeCl2中混有FeCl3杂质(Cl2) |
| C、CO气体中混有CO2杂质(NaOH溶液) |
| D、FeCl3中混有FeCl2杂质(铁屑) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com