
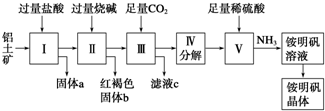
分析 铝土矿用盐酸溶解,Al2O3、Fe2O3与盐酸反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色固体b为氢氧化铁,溶液Ⅲ中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,碳酸的酸性强于偏铝酸,故二氧化碳与偏铝酸钠生成氢氧化铝沉淀;
(2)Al2O3与稀硫酸、氨气反应生成铵明矾溶液;依据从可溶性溶液中获取固体的实验方法回答;
(3)氢氧化铝是两性氢氧化物溶于强酸强碱,不溶于弱酸弱碱;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可.
解答 解:铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体,
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2,Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3沉淀,
故答案为:SiO2; AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓;
(2)Al(OH)3分解生成Al2O3,Al2O3与稀硫酸、氨气反应生成铵明矾溶液,反应的化学方程式为:Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O或Al2(SO4)3+H2SO4+2NH3=2NH4Al(SO4)2,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O或Al2(SO4)3+H2SO4+2NH3=2NH4Al(SO4)2;蒸发浓缩;
(3)步骤Ⅱ是AlCl3、FeCl3及剩余的HCl溶液中加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,氢氧化铝是两性氢氧化物溶于强酸强碱,不溶于弱酸弱碱,若用氨水代替烧碱只能生成氢氧化铝沉淀和氢氧铁沉淀,不能将氢氧化铁和氢氧化铝分离,
故答案为:不可以; Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,则Al3+共3 mol,SO42-共5 mol,根据Al3+和SO42-守恒原理可得,加入Al2O3和H2SO4的物质的量之比为:$\frac{3}{2}$:5=3:10,
故答案为:3:10.
点评 本题主要考查的是无机非金属材料的流程与应用,题目难度中等,考查的是学生综合分析问题的能力,掌握基础是解题关键.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
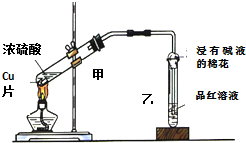 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
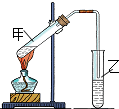 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
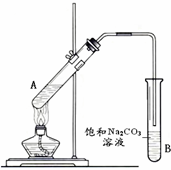 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
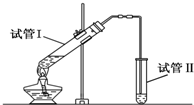 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com