
科目:高中化学 来源: 题型:
| A、11.2g | B、5.6g |
| C、2.8g | D、1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、146 | B、114 |
| C、92 | D、46 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 h后反应进行完全,容器中的N2浓度为0.55 mol?L-1 |
| B、前20 min用NH3表示的反应速率为0.01 mol?L-1?min-1 |
| C、增加H2的浓度或降低温度,平衡将向正反应方向移动,且反应速率均加快 |
| D、当容器内压强不改变时,说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
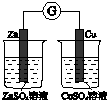 | 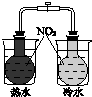 | 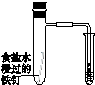 | 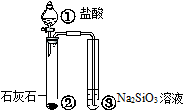 |
| 验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁 发生析氢腐蚀 | 验证H2CO3的酸性大于H2SiO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它的中子数是118 |
| B、它是第八周期元素 |
| C、它是活泼的金属元素 |
| D、它的最外层电子数是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
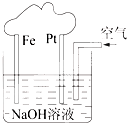
| A、这是一个电解池装置 |
| B、这是电解NaOH溶液的装置 |
| C、该装置中Fe为阴极,电极反应为:Fe-2e-+2OH-=Fe(OH)2 |
| D、该装置中Pt为正极,电极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com