
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
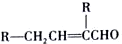
 .
. .
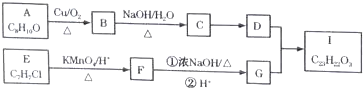
.分析 A-I均为芳香族化合物,A的苯环上只有一个取代基,根据A的分子式可知A的侧链为饱和结构,A能够催化氧化生成B,B能够发生银镜反应,且能够发生信息③中反应,则B分子中侧链-CH2CHO结构,故B的结构简式为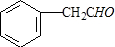 ,A为
,A为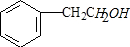 ,则C为
,则C为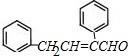 ,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为
,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为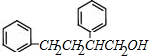 ;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为
;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为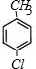 ;E被酸性高锰酸钾溶液氧化成F,则F为
;E被酸性高锰酸钾溶液氧化成F,则F为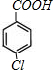 ;F在浓NaOH溶液中加热发生水解反应生成酚羟基和羧酸钠,然后在酸性条件下转化成G,则G为
;F在浓NaOH溶液中加热发生水解反应生成酚羟基和羧酸钠,然后在酸性条件下转化成G,则G为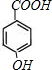 ,G和D发生酯化反应生成I,则I为
,G和D发生酯化反应生成I,则I为 ,据此进行解答.
,据此进行解答.
解答 解:A-I均为芳香族化合物,A的苯环上只有一个取代基,根据A的分子式可知A的侧链为饱和结构,A能够催化氧化生成B,B能够发生银镜反应,且能够发生信息③中反应,则B分子中侧链-CH2CHO结构,故B的结构简式为 ,A为
,A为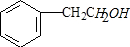 ,则C为
,则C为 ,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为
,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为 ;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为
;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为 ;E被酸性高锰酸钾溶液氧化成F,则F为
;E被酸性高锰酸钾溶液氧化成F,则F为 ;F在浓NaOH溶液中加热发生水解反应生成酚羟基和羧酸钠,然后在酸性条件下转化成G,则G为
;F在浓NaOH溶液中加热发生水解反应生成酚羟基和羧酸钠,然后在酸性条件下转化成G,则G为 ,G和D发生酯化反应生成I,则I为
,G和D发生酯化反应生成I,则I为 .
.
(1)A→B为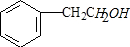 催化氧化生成
催化氧化生成 ,该反应为氧化反应;G为
,该反应为氧化反应;G为 ,其分子中含有官能团为羟基、羧基,
,其分子中含有官能团为羟基、羧基,
故答案为:氧化反应;羟基、羧基;
(2)E到G的反应中需要分别引进酚羟基和羧基,由于酚羟基容易被酸性高锰酸钾溶液氧化,所以E→F与F→G的顺序不能颠倒,
故答案为:否;如果颠倒,则(酚)羟基会被KMnO4/H+氧化;
(3)B分子中含有醛基,能够与与银氨溶液发生反应生成单质银,反应的化学方程式为: ,
,
故答案为: ;
;
(4)G和D发生酯化反应生成I,I的结构简式为: ,
,
故答案为: ;
;
(5)A为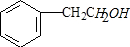 ,其同分异构体符合:①遇氯化铁溶液显紫色,说明含有酚羟基,②属于芳香族化合物,侧链为-OH、-CH2CH3,有邻、间、对3种,侧链为1个-OH、2个-CH3,当2个-CH3处于邻位时,-OH有2种位置,当2个-CH3处于间位时,-OH有3种位置,当2个-CH3处于对位时,-OH有1种位置,符合条件的同分异构体共有9种
,其同分异构体符合:①遇氯化铁溶液显紫色,说明含有酚羟基,②属于芳香族化合物,侧链为-OH、-CH2CH3,有邻、间、对3种,侧链为1个-OH、2个-CH3,当2个-CH3处于邻位时,-OH有2种位置,当2个-CH3处于间位时,-OH有3种位置,当2个-CH3处于对位时,-OH有1种位置,符合条件的同分异构体共有9种
(6)CH3CH2OH为原料制备CH3CH2CH2CH2OH,先将乙醇催化氧化生成乙醛,然后让乙醛发生信息反应③生成CH3CH=CHCHO,与氢气加成生成CH3CH2CH2CH2OH,所以合成流程为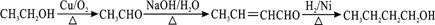 ,
,
故答案为: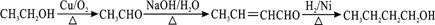 .
.
点评 本题考查有机物推断与合成,题目难度中等,综合分析确定B的结构简式,再结构反应条件进行推断,需要学生熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:解答题
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH | |
| B. | pH=a的CH3COOH溶液加水稀释10n倍后,pH=a+n | |
| C. | pH相等的CH3COONa、NaOH溶液中,水的电离程度相同 | |
| D. | Na2CO3溶液中:c(OH-)=c(H+)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
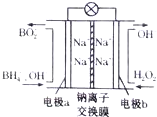 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 该电池的负极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 电极a采用Mn02作电极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
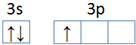 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的NO2和CO2混合气体中含有的氧原子数为4NA | |
| B. | 密闭容器中,46gNO2和N2O4的混合气体所含分子个数为NA | |
| C. | 常温常压下,22.4L的液态水含有2.24×10-8NA个OH- | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com