
| A. | 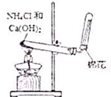 实验室制取NH3 | B. | 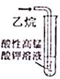 溶液颜色褪去 | C. | 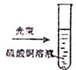 看到光亮的通路 | D. | 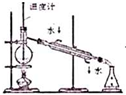 石油蒸馏 |
分析 A.铵盐与碱加热可制取氨气,利用向下排空气法收集氨气;
B.乙烷不能被高锰酸钾氧化;
C.硫酸铜溶液不是胶体分散系;
D.蒸馏测定馏分的温度,且冷水下进上出.
解答 解:A.铵盐与碱加热可制取氨气,利用向下排空气法收集氨气,图中制取、收集均合理,故A正确;
B.乙烷不能被高锰酸钾氧化,则不能观察到溶液褪色,故B错误;
C.硫酸铜溶液不是胶体分散系,则不能观察到光亮的通路,故C错误;
D.蒸馏测定馏分的温度,且冷水下进上出,图中温度计水银球应在烧瓶支管口处,冷却水方向不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、性质实验及混合物分离提纯实验等,把握实验原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
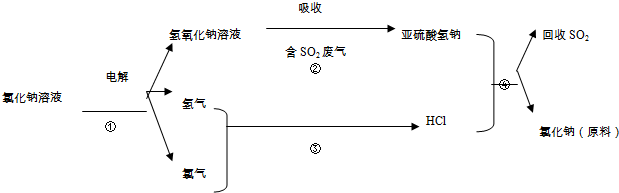
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
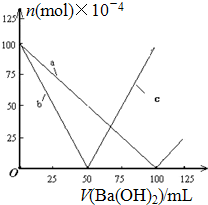
| A. | 曲线a表示Ba2+的物质的量的变化 | |
| B. | 曲线c表示OH-的物质的量的变化 | |
| C. | 加入Ba(OH)2溶液50mL时反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用石墨棒作电极电解CuCl2溶液:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$ Cu+Cl2↑ | |
| C. | 硫酸铝溶液与过量氢氧化钠溶液反应的离子方程式:Al3++3OH-═Al(OH)3↓ | |
| D. | 用醋酸巧除水垢的反应:CaC03+2H+═Ca2++C02↑+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
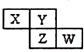 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | Z的离子半径小于Y的离子半径 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
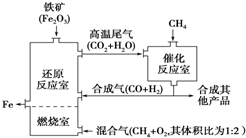
| A. | 加入铁矿石时,将铁矿石粉碎,目的是加快反应速率提高原料利用率 | |
| B. | 增大催化反应室的压强,甲烷的转化率增大 | |
| C. | 设置燃烧室的目的是产生CO2和水蒸气作原料气与甲烷反应 | |
| D. | 催化反应室需维持在550~750℃,目的仅是提高CH4转化的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以鉴别羊毛和棉花 | |
| B. | 用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| C. | 用酒精清洗沾到皮肤上的苯酚 | |
| D. | 用酸性高猛酸钾溶液鉴别甲苯和苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
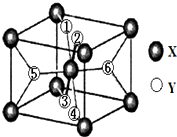 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com