
将氯气用导管通入较浓的NaOH和 的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的
的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的 被
被 还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.
还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.
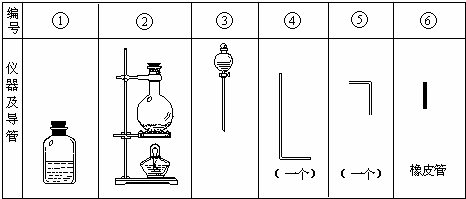
进行此实验,所用的仪器及导管如图.
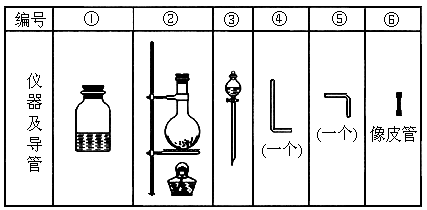
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图编号)是______.
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是______.
(3)仪器①的橡皮塞上应有______个孔,原因是______.
(4)实验时,仪器①中除观察到红光外还有______现象.
(5)实验需用约10% 溶液100毫升,现用市售30%(密度近似为
溶液100毫升,现用市售30%(密度近似为 )
) 来配制,其具体配制方法是:____________________.
来配制,其具体配制方法是:____________________.
(6)实验时仪器①中 与
与 反应的离子方程式是:____________.
反应的离子方程式是:____________.
|
(1) ③②⑤(2) ②⑤⑥④①或③②⑤⑥④①(3)2 ,使瓶内外压强相等(4) 冒气泡(5) 设 体积xml 体积xml  x=33.3mL x=33.3mL
用量筒量取 33mL30%的 溶液加入烧杯中, 溶液加入烧杯中,
再加 67mL水,搅拌均匀(6) 组装氯气发生装置,应选择②、③和一支导管.而导管④、⑤每种仅有 1个,从烧瓶中导出 应选⑤,把④留作向①中通入 应选⑤,把④留作向①中通入 用. 用.
气体流经的仪器,应从②开始到①为止,中间依次是⑤、⑥、④. ②中产生的  经导管通入①的混合液中发生反应,还要产生在水中溶解性不好的 经导管通入①的混合液中发生反应,还要产生在水中溶解性不好的 ,所以①的橡皮塞上既要有气体导入的孔,又要有多余 ,所以①的橡皮塞上既要有气体导入的孔,又要有多余 和新生成的 和新生成的 导出的孔. 导出的孔.
实验需用约 10% 溶液100mL. 溶液100mL.
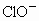 与 与 的反应是氧化还原反应,而且是 的反应是氧化还原反应,而且是 被 被 还原,产生 还原,产生 .因此, .因此, 是氧化剂, 是氧化剂, 是还原剂;氧化产物是 是还原剂;氧化产物是 ,还原产物是 ,还原产物是 .在NaOH溶液里 .在NaOH溶液里 的还原产物只能是 的还原产物只能是 . . |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省新民市高三上学期期末考试化学试卷(解析版) 题型:填空题
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。

Ⅰ.测定过氧化氢的含量
(1)取10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式: _____________________________________________________
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为:_________________________。
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是__________,写出产生气体这一现象的反应的化学方程式__________________________。
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三上学期期中考试化学试卷(解析版) 题型:实验题
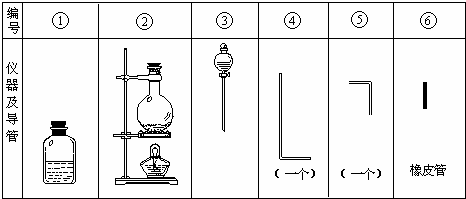
将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出。本实验所用的仪器及导管如图。
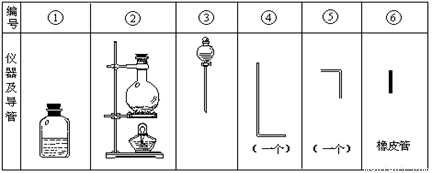
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为 (填写图中编号)。
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 。
(3)仪器①的橡皮塞上至少应有2个孔的原因是 。
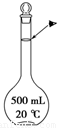
(4)本实验需配置10mol·L-1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有 (填仪器名称) ,定容时操作如图,则所配溶液浓度 (填“偏高”或“偏低”)。
(5)实验时仪器①中ClO-与H2O2反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com