
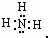 ,H2O的结构式为:H-O-H.
,H2O的结构式为:H-O-H. 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.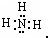 ,H-O-H
,H-O-H 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.

 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
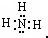
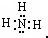
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


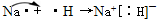
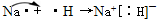




查看答案和解析>>
科目:高中化学 来源: 题型:
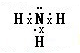
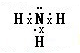
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
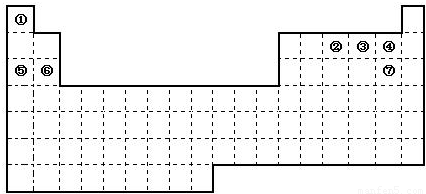
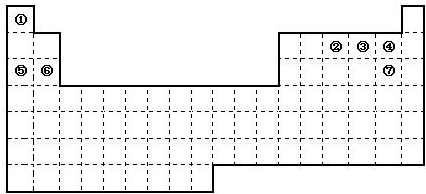
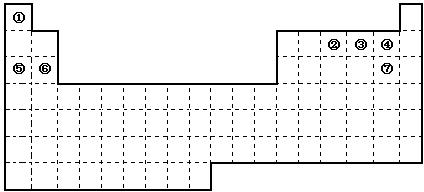
(16分)图是元素周期表的框架,依据元素周期表回答下列问题:
(1)周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是 (用化学式表示),周期表中的元素④和元素⑦的氢化物的沸点高低顺序是 (用化学式表示)。
(2)①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是 (填写化学式)。
(3)①和②的单质在一定条件下转化为化合物A,请写出该反应的化学方程式 ,及A的结构式 。
(4)②和硅形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是 , 与该化合物晶体类型相同的是______(请用相应的编号填写)。
(5)请写出工业上用电解饱和食盐水制备⑦单质的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com