
分析 (1)①利用盖斯定律,将热化学方程式进行运算,(③-①+②)×$\frac{1}{2}$计算反应的焓变,得到SO3 (g)与H2O(l)反应的热化学方程式;
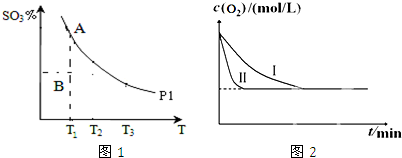
②B状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行;反应2SO2(g)+O2(g)?2SO3(g)是气态体积减小的反应,P2>P1 ,增大压强,平衡正向进行相同温度下三氧化硫百分含量增大,据此画出图象;
③与实验Ⅰ比较,实验Ⅱ达到平衡时间少,说明反应速率增大,但平衡不移动,应加入催化剂;
(2)①根据平均降解速率v=$\frac{△c}{△t}$进行计算;
②对比溶液的酸性强弱对R的降解速率的影响进行判断;
(3)通过题意求出平衡浓度,带入K值可以得出转化率.
解答 解:(1)①2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①+②)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
②B状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,反应2SO2(g)+O2(g)?2SO3(g)是气态体积减小的反应,P2>P1 ,增大压强,平衡正向进行相同温度下三氧化硫百分含量增大,画出的图象为: ,
,
故答案为:>; ;
;
③与实验Ⅰ比较,实验Ⅱ达到平衡时间少,说明反应速率增大,但平衡不移动,应加入催化剂,而压强、温度都可使平衡移动,
故答案为:使用催化剂;
(2)①在20-25min之间,pH=10时R的平均降解速率为$\frac{0.6-0.4}{5}$×10-4=4×10-6mol•L-1•min-1,
故答案为:4×10-6mol•L-1•min-1;
②溶液酸性越强,即pH越小,线的斜率越大,可以知道R的降解速率越大,
故答案为:溶液酸性越强,R的降解速率越大;
(3)K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$=$\frac{0.5x×0.5x}{(1-x)^{2}}$=1,
解之得:x=67,
故答案为:67%.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及化学反应的吸放热于反应物产物能量之间的关系、热化学方程式和盖斯定律的计算等知识,难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
某含Na+的溶液中可能含有NH 、Fe3+、Br-、CO
、Fe3+、Br-、CO 、I-、SO
、I-、SO 。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有( )
。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有( )
A.取样,滴加硫氰化钾溶液
B.取样,加氯水和CCl4,振荡
C.取样,加足量盐酸加热,湿润的品红试纸检验气体
D.取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:填空题
写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.2K+2H2O=2KOH+H2↑
B.Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
C.2Cu(NO3)2=2CuO+4NO2↑ +O2↑
D.3CO+Fe2O3=2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
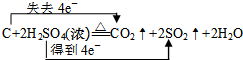 .
.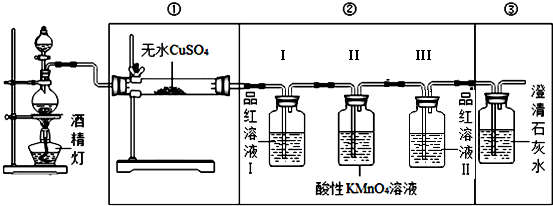
| 实验装置 | ① | ③ |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
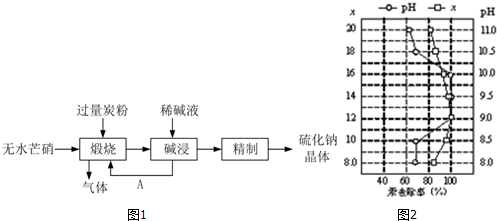
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com