
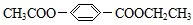 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: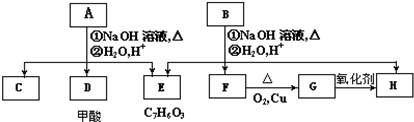
 ,由E的分子式可知,E为
,由E的分子式可知,E为 ,F能连续发生氧化反应得到H,则F为CH3CH2OH,G为CH3CHO,H为CH3COOH,芳香化合物A、B互为同分异构体,A在碱性条件下水解、酸化得到E、甲酸与C,(3)中A有两种可能的结构,其中一种结构中所有氢原子处于5种不同环境,则C为(CH3)2CHOH,故A为
,F能连续发生氧化反应得到H,则F为CH3CH2OH,G为CH3CHO,H为CH3COOH,芳香化合物A、B互为同分异构体,A在碱性条件下水解、酸化得到E、甲酸与C,(3)中A有两种可能的结构,其中一种结构中所有氢原子处于5种不同环境,则C为(CH3)2CHOH,故A为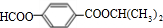 ,据此解答.
,据此解答. ,由E的分子式可知,E为
,由E的分子式可知,E为 ,F能连续发生氧化反应得到H,则F为CH3CH2OH,G为CH3CHO,H为CH3COOH,芳香化合物A、B互为同分异构体,A在碱性条件下水解、酸化得到E、甲酸与C,(3)中A有两种可能的结构,其中一种结构中所有氢原子处于5种不同环境,则C为(CH3)2CHOH,故A为
,F能连续发生氧化反应得到H,则F为CH3CH2OH,G为CH3CHO,H为CH3COOH,芳香化合物A、B互为同分异构体,A在碱性条件下水解、酸化得到E、甲酸与C,(3)中A有两种可能的结构,其中一种结构中所有氢原子处于5种不同环境,则C为(CH3)2CHOH,故A为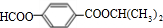 ,
, ,含氧官能团的名称是羧基、羟基,故答案为:羧基、羟基;
,含氧官能团的名称是羧基、羟基,故答案为:羧基、羟基; 、甲酸与C,A有两种可能的结构,其中一种结构中所有氢原子处于5种不同环境,则C为(CH3)2CHOH,故A为
、甲酸与C,A有两种可能的结构,其中一种结构中所有氢原子处于5种不同环境,则C为(CH3)2CHOH,故A为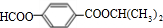 ,故答案为:
,故答案为: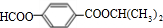 ;
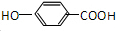
; )的同分异构体,其中一种能发生水解反应,说明含有酯基,且苯环上的一氯取代物只有2种,取代基为-OH、-OOH,且处于对位,故该同分异构体结构为:
)的同分异构体,其中一种能发生水解反应,说明含有酯基,且苯环上的一氯取代物只有2种,取代基为-OH、-OOH,且处于对位,故该同分异构体结构为: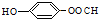 ,
, ;
;| △ |
| △ |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A、用50 mL 12 mol/L的
| ||||||
B、常温下,将1 g
| ||||||
C、向100 mL 3 mol/L的稀硝酸中加入5.6 g
| ||||||
D、常温常压下,0.1 mol
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定大于92.2 kJ |
| B、一定小于92.2 kJ |
| C、一定等于92.2 kJ |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是| A、曲线II对应的条件改变是减小压强 |
| B、若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
| C、在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D、在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com