
| A. | 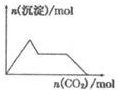 含0.0l mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 | |
| B. | 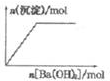 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | |
| C. | 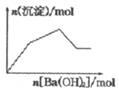 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 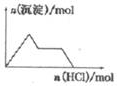 NaAlO2溶液中逐滴加入盐酸 |
分析 A、向一定量的氢氧化钙和氢氧化钾溶液中通入二氧化碳,开始先和氢氧化钙反应,会生成碳酸钙,当氢氧化钙完全反应后,再和氢氧化钾反应,最后将碳酸钙溶解;
B、NaHSO4溶液中逐滴加入Ba(OH)2溶液会产生越来越多的硫酸钡白色沉淀;
C、KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液开始铝离子和硫酸根逐渐形成沉淀,然后形成的氢氧化铝逐渐溶解,直到只剩余硫酸钡为止,结合具体数据分析反应过程;
D、NaAlO2溶液中逐滴加入盐酸,开始出现沉淀,然后沉淀逐渐溶解.
解答 解:A、向一定量的氢氧化钙和氢氧化钾溶液中通入二氧化碳,开始先和氢氧化钙反应,会逐渐生成碳酸钙沉淀,沉淀量逐渐增大,当氢氧化钙完全反应后,再和氢氧化钾反应,此时沉淀量不变,当氢氧化钾消耗完毕时,将碳酸钙逐渐溶解,沉淀量逐渐减少,故A错误;
B、NaHSO4溶液中逐滴加入Ba(OH)2溶液会产生越来越多的硫酸钡白色沉淀,直到最大量,然后不再减少,沉淀的量保持不变,故B正确;
C、假设含2molKAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,开始阶段滴加入3molBa(OH)2时,2mol铝离子和3mol硫酸根分别和氢氧根和钡离子反应生成2mol氢氧化铝和3mol硫酸钡沉淀共5mol沉淀,然后再滴加入1molBa(OH)2时,继续形成1mol的硫酸钡沉淀但同时有会溶解2mol氢氧化铝沉淀,所以这一段沉淀的物质的量并没有增多反而减小,再滴加入Ba(OH)2时无反应发生最终只剩余硫酸钡沉淀,故C错误;
D、NaAlO2溶液中逐滴加入盐酸,开始出现沉淀,然后过量的盐酸又将沉淀逐渐溶解掉,故D错误.
故选B.
点评 本题考查了图象分析,明确物质间的反应及物质的性质是解本题关键,根据物质之间量的关系进行解答,难点是根据其分界点确定发生的反应,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw变大 | |
| B. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属之间形成的化学键一定是共价键 | |
| B. | 在共价化合物中不可能含有离子键 | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 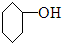 $\stackrel{浓H_{2}SO_{4}△}{→}$ $\stackrel{浓H_{2}SO_{4}△}{→}$ +H2O +H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O | |
| C. | 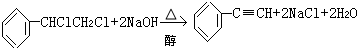 | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
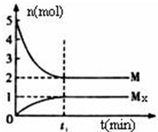 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A. | 平衡时混合气体的平均摩尔质量是33.3g/mol | |
| B. | t1时刻,保持温度不变,再充入5molM,重新达到平衡时,c(Mx)/c(M)将减小 | |
| C. | 该反应的化学方程式是2HF?(HF)2 | |
| D. | M的沸点比同主族下一周期元素的气态氢化物沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 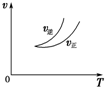 可判断正反应为放热反应 | |
| B. | 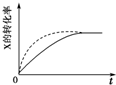 虚线表示可能使用了催化剂或是加压 | |
| C. | 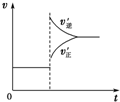 若正反应的△H<0,可表示升高温度使平衡向逆反应方向移动 | |
| D. | 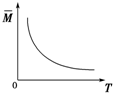 气体平均相对分子质量随温度变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

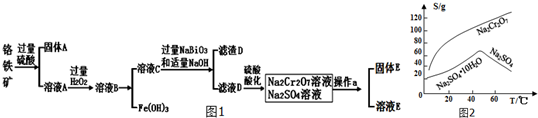
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定很容易发生 | |
| B. | 化学反应一定既伴随着物质变化又伴随着能量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物溶于水显酸性且稳定性弱于HF | |
| B. | Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com