
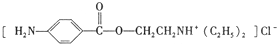 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: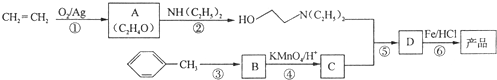

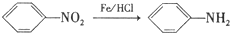
 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式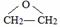 ;D在Fe/HCl条件下发生反应生成产品,D结构简式为
;D在Fe/HCl条件下发生反应生成产品,D结构简式为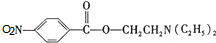 ,根据反应⑤知,C的结构简式为
,根据反应⑤知,C的结构简式为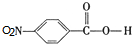 ,B被氧化生成C,结合题给信息知,B结构简式为
,B被氧化生成C,结合题给信息知,B结构简式为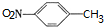 ,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,据此分析解答.
,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,据此分析解答.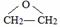 ;D在Fe/HCl条件下发生反应生成产品,D结构简式为
;D在Fe/HCl条件下发生反应生成产品,D结构简式为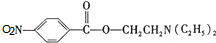 ,根据反应⑤知,C的结构简式为
,根据反应⑤知,C的结构简式为 ,B被氧化生成C,结合题给信息知,B结构简式为
,B被氧化生成C,结合题给信息知,B结构简式为 ,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,
,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,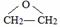 ,故答案为:
,故答案为: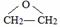 ;
; ,C中含有的含氧官能团的名称为为硝基、羧基,
,C中含有的含氧官能团的名称为为硝基、羧基, ;硝基、羧基;
;硝基、羧基; +HOCH2CH2N(C2H5)2
+HOCH2CH2N(C2H5)2| 一定条件下 |
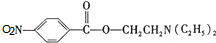 +H2O,
+H2O, +HOCH2CH2N(C2H5)2
+HOCH2CH2N(C2H5)2| 一定条件下 |
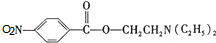 +H2O;
+H2O; ,B的某种同系物E,相对分子质量比B大28,其中-NO2与苯环直接相连,符合条件的有多种,其中一种结构简式为
,B的某种同系物E,相对分子质量比B大28,其中-NO2与苯环直接相连,符合条件的有多种,其中一种结构简式为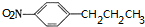 ,
, ;
; )是人体必需的氨基酸之一,因为含有氨基和羧基,所以能发生缩聚反应,其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,因为含有氨基和羧基,所以能发生缩聚反应,其发生缩聚反应的化学方程式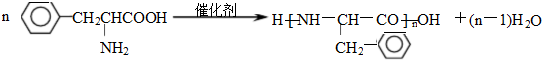 ,
,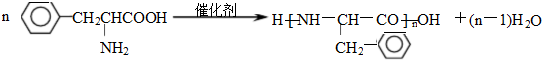 .
.


科目:高中化学 来源: 题型:
 25℃时,向20.00ml的NaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴定过程中,溶液的pH与滴入CH3COOH溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和.则下列说法中,错误的是( )
25℃时,向20.00ml的NaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴定过程中,溶液的pH与滴入CH3COOH溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和.则下列说法中,错误的是( )| A、CH3COOH溶液的浓度为0.1mol?L-1 |
| B、图中点①到点③所示溶液中,水的电离程度先增大后减小 |
| C、点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-) |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用装置进行铜和浓硫酸的反应 |
B、 用装置收集二氧化硫并吸收尾气 |
C、 用装置稀释反应后的混合液 |
D、 用装置测定余酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷与氯气光照反应 |
| B、乙烯与氯化氢气体混合 |
| C、乙烯与氯气混合 |
| D、乙烯通入浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com