
 ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应. 分析 (1)乙烯的产量标志着一个国家的石油发展水平;
(2)苯性质较稳定,和一般的氧化剂、强酸、强碱不反应;
(3)①乙烯和溴发生加成反应生成1,2-二溴乙烷;
②苯和溴在溴化铁作催化剂条件下发生取代反应.
解答 解:(1)乙烯的产量标志着一个国家的石油发展水平,所以乙烯的产量是衡量一个国家石油化工发展水平的标志,故答案为:乙烯;
(2)苯性质较稳定,和一般的氧化剂、强酸、强碱不反应,所以苯不能被酸性高锰酸钾溶液氧化,故答案为:不能;
(3)①乙烯和溴发生加成反应生成1,2-二溴乙烷,反应方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2BrCH2Br;
②苯和溴在溴化铁作催化剂条件下发生取代反应生成溴苯和HBr,故答案为:取代.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查乙烯和苯的性质,注意:苯不能被酸性高锰酸钾溶液氧化,但连接苯环的碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化生成苯甲酸,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
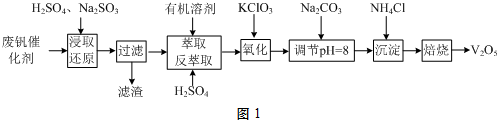
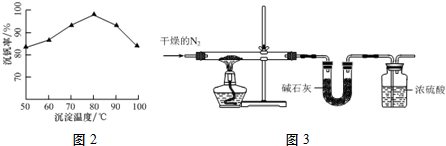
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
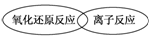 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
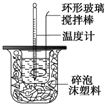
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com