
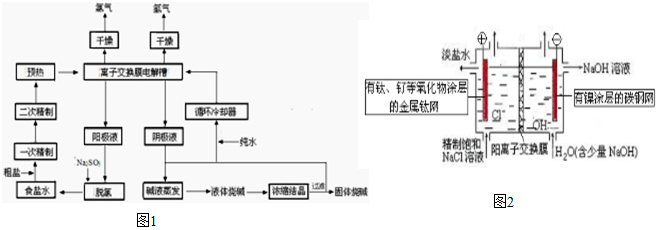
分析 (1)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(2)根据粗盐中含有的杂质离子,除去硫酸根离子用过量的钡离子,除去过量的钡离子和钙离子使用碳酸钠试剂,除去镁离子和铁离子使用氢氧化钠试剂;
(3)根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;粗盐经过加入碳酸钠和氢氧化钠精制后含有少量的钙离子和镁离子根据题意只能通过阳离子交换塔除去;
(4)温度升高气体的溶解性减小,离子迁移速度加快,增大溶液的导电性;由于电解时在阴极消耗水电离产生的氢离子氢氧根离子的浓度增大阳离子交换膜让Na+通过使膜两边溶液呈电中性;生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜阻止上述情况的发生.
(5)根据反应2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,当制得32.0%的烧碱溶液0.507t即生成NaOH的物质的量为4056mol时,反应中需要转移的电子的物质的量为4056mol,在实际生产中消耗的电子的物质的量为3600 s/h×8 h×1.45×104C/s÷96500 C/mol=4327.5mol,根据电流效率=$\frac{需要转移的电子的物质的量}{实际生产中消耗的电子的物质的量}$×100%计算.
解答 解:(1)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,反应的离子方程式为SO32-+Cl2+H2O═SO42-+Cl-+2H+,
故答案为:SO32-+Cl2+H2O═SO42-+Cl-+2H+;
(2)根据粗盐中含有的杂质离子,除去硫酸根离子用过量的钡离子,除去过量的钡离子和钙离子使用碳酸钠试剂,除去镁离子和铁离子使用氢氧化钠试剂,
故答案为:Ca2+、Ba2+(多答Fe3+不扣分)、Mg2+;
(3)处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,与电解生成的OH-反应生成难溶氢氧化物,堵塞阳膜孔隙,粗盐经过加入碳酸钠和氢氧化钠精制后含有少量的钙离子和镁离子根据题意只能通过阳离子交换塔除去,故选C,
故答案为:与电解生成的OH-反应生成难溶氢氧化物;C;
(4)温度升高气体的溶解性减小,离子迁移速度加快,增大溶液的导电性,由于电解时在阴极消耗水电离产生的氢离子氢氧根离子的浓度增大阳离子交换膜让Na+通过使膜两边溶液呈电中性,生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜可以阻止上述情况的发生,
故答案为:增大溶液的导电性(或离子迁移速度加快)、减小氯气在溶液中的溶解;让Na+通过使膜两边溶液呈电中性、防止氢氯混合发生爆炸、防止氯气与NaOH反应生成NaClO和NaCl影响烧碱的质量;
(5)根据反应2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,当制得32.0%的烧碱溶液0.507t即生成NaOH的物质的量为4056mol时,反应中需要转移的电子的物质的量为4056mol,在实际生产中消耗的电子的物质的量为3600 s/h×8 h×1.45×104C/s÷96500 C/mol=4327.5mol,所以电流效率=$\frac{需要转移的电子的物质的量}{实际生产中消耗的电子的物质的量}$×100%=$\frac{4056mol}{4327.5mol}$×100%=93.7%,
故答案为:93.7%.
点评 本题考查氯碱工业,侧重考查学生电解原理、有关计算、氧化还原反应等知识点,明确各个电极上发生的反应,难点是离子方程式的书写,题目难中等.


科目:高中化学 来源: 题型:选择题
| A. | 1molOH-离子中含电子数目为10NA | |
| B. | 0.5L 0.2mol•L-1的NaCl溶液中含有的Na+数是0.1NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量约为28 g | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

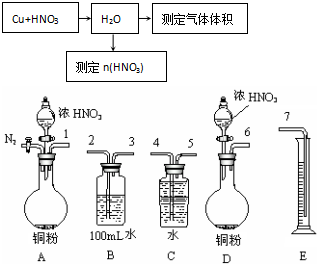
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2具有强的氧化性,可以做供氧剂 | |
| B. | Na2CO3溶液呈碱性,可以清除餐具表面的油污 | |
| C. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
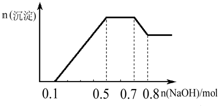
| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中一定不含CO32-,一定含有SO42-和NO3- | |
| C. | 溶液中n(NH4+)=0.2 mol | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
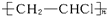 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com