
| 物质(杂质) | 试剂 | 方法 | |
| A | Cl2(HCl) | 饱和食盐水,浓硫酸 | 洗气 |
| B | 溴化钠(溴) | CCl4、水 | 萃取、分液 |
| C | 乙醇(乙酸) | NaOH溶液 | 分液 |
| D | 溴苯(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气极易溶于水,食盐水抑制氯气的溶解,浓硫酸可干燥氯气;
B.溴不易溶于水,易溶于四氯化碳;
C.乙酸与NaOH反应后,增大与乙醇的沸点差异;
D.溴与NaOH溶液反应后,与溴苯分层.
解答 解:A.氯气极易溶于水,食盐水抑制氯气的溶解,浓硫酸可干燥氯气,利用洗气可除杂,故A正确;
B.溴不易溶于水,易溶于四氯化碳,则萃取、分液可分离,故B正确;
C.乙酸与NaOH反应后,增大与乙醇的沸点差异,不分层,应选蒸馏法分离,故C错误;
D.溴与NaOH溶液反应后,与溴苯分层,然后分液可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应是解本题关键,侧重分析与应用能力的考查,注意分离方法的选择,题目难度不大.


科目:高中化学 来源: 题型:解答题
 MgBr2
MgBr2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分反应后放出热量为Q | |
| B. | 增大压强,平衡右移,Q值变大 | |
| C. | 若生成1molSO3(s),放出热量大于$\frac{Q}{2}$ | |
| D. | 使用催化剂,改变反应途径,Q值也随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
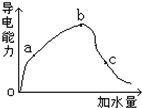 一定温度下,甲酸加水稀释过程中溶液的导电能力如图所示曲线,请回答:
一定温度下,甲酸加水稀释过程中溶液的导电能力如图所示曲线,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:
1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| D. | 向反应后的溶液加入乙醇,溶液没有发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液一定呈中性 | |
| B. | [OH-]=1×10-6 mol•L-1的溶液一定呈碱性 | |
| C. | [OH-]<[H+]的溶液一定呈酸性 | |
| D. | 室温下由水电离出来的[H+]=1×10-12 mol•L-1的溶液一定呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com