
溴(Br)与氯同属“卤族”元素,其单质在化学性质上具有相似性,但Cl2比Br2的活泼性强,下面是根据氯的性质对溴的性质的预测,其中不正确的是( )。
A.溴单质常温下为液态,但极容易挥发为溴蒸气
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴离子可以用硝酸酸化的AgNO3酸性溶液来检验
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列实验方法能达到实验目的的是
A.用淀粉溶液检验溶液中是否存在碘单质 B.用分液漏斗分离水与乙醇的混合物
C.用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 D.用向下排空气法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
I2(g)+H2(g) 2HI(g) △H<0,在其他条件不变的情况下正确说法是 ( )
2HI(g) △H<0,在其他条件不变的情况下正确说法是 ( )
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L—1 H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。已知:金属离子氢氧化物沉淀所需pH是
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3. 3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A.MgO B.Na2CO3 C.蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如图所示。
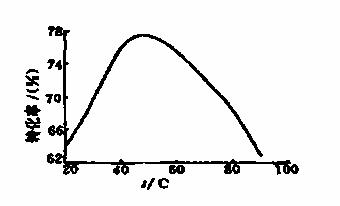
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写错误的是( )。
A.氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
B.二氧化锰与浓盐酸共热制:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.用氢氧化钠溶液吸收氯气:Cl2+2OH-==Cl-+ClO-+H2O
D.向稀漂粉精溶液中通人少量二氧化碳:Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中的MnO2和浓盐酸共热制Cl2,反应如下:MnO2+4HCl (浓) NaCl2+2H2O+Cl2↑用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到氯气的物质的量是( )
NaCl2+2H2O+Cl2↑用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到氯气的物质的量是( )
A.等于2 mol B.等于1 mol C.小于1 mol D.大于2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作错误的是( )
A.用药匙取用粉末状或小颗粒状固体
B.用胶头滴管滴加少量液体
C.给盛有2/3体积液体的试管加热
D.倾倒液体时试剂瓶标签面向手心
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO4在水溶液中能够电离出Na+、H+和SO42-。下列对于NaHSO4的分类不正确的是( )
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11. 2 L
B.25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5NA
C.标准状况下,11.2 L H2O含有的原子数为1.5NA
D.常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com