
为探讨反应X+Y Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反 应速率的判断正确的是( )
应速率的判断正确的是( )
c(X) | c(Y) | 所需时间(秒) |
0.10 | 0.10 | 0.60s |
0.20 | 0.10 | 0.15s |
0.20 | 0.05 | 0.30s |
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:填空题
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(△H<0)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(△H<0)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
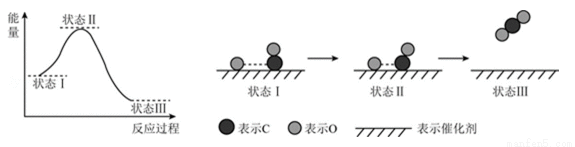
下列说法中正确的是( )
A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.相同条件下,溶液中Fe3+、Zn2+ 、Cu2+的氧化性依次减弱
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.根据反应2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在体积为2L的密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2+O2 2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
A.小于1.2 mol B.1.2 mol C.大于1.6 mol D.1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、Cl- | |
| B. | 和Al反应能产生氢气的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 中性溶液:Al3+、K+、SO42-、Cl- | |
| D. | c(H+)<c(OH-)的溶液:Na+、K+、SO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com