
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
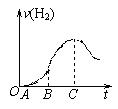
 2NH3,其反应速率分别为v(H2)、v(N2)、v(NH3) (用mol·L-1·s-1表示),则正确的关系式是( )
2NH3,其反应速率分别为v(H2)、v(N2)、v(NH3) (用mol·L-1·s-1表示),则正确的关系式是( )| A.v(H2)=v(N2)=v(NH3) | B.v(N2)=2v(NH3) |
| C.2v(H2)=3v(NH3) | D.v(N2)=3v(H2) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用锌粒来表示10s内该反应的速率为0.013g/s |
| B.忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L·s) |
| C.忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L·s) |
| D.用H2来表示10s内该反应的速率为0.004mol/(L·s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)在四种不同情况下的反应速率如下,其中反应进行得最快的是
C(g)+D(g)在四种不同情况下的反应速率如下,其中反应进行得最快的是| A.vA=0.15 mol/(L·min) | B.vB=0.6 mol/(L·min) |
| C.vC=0.4 mol/(L·min) | D.vD=0.2 mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
,其中气体M、气体N的物质的量随时间变化的曲线如图所示: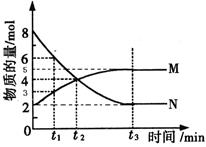
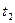 时刻,正逆反应速率大小V正 V逆。
时刻,正逆反应速率大小V正 V逆。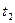 =2min,计算反应开始至
=2min,计算反应开始至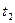 时刻,M的平均化学反应速率为:_____________________________。
时刻,M的平均化学反应速率为:_____________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纯锌与稀硫酸反应 | B.纯锌与浓硫酸反应 |
| C.含铜、铅等杂质的粗锌与稀硫酸反应 | D.粗锌与稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | T/K | 大理石 质量/g | 规格 | HNO3浓度/mol·L-1 | HNO3 体积/ mL | 实验目的 |
| ① | 298 | 10.00 | 粗 | 1.00 | 25.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
| 实验操作 | 预期现象与结论 |
| 步骤1 | |
| 步骤2 | |
| 步骤3 | |
| …… | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com