
�ڸ��������������£�ijͬѧ��һ�鲿�ֱ��������ƿ���һ���ѳ�ȥ����Ĥ���������һЩС���������ã�Ȼ�����ʢ��ˮ�ҵ�����ˮ���е������ڡ����ƿ鷴Ӧ��ȫ���������н��ռ���1.12 L��������״��������ʱ������������ȷ�Ӧǰ������0.27 g��ˮ�ۺ���������Һ�������Ϊ2.0 L����Һ��NaOH��Ũ��Ϊ0.050 mol·L-1��������Һ�����ӵ�ˮ����ܽ��������������
��1��д����ʵ���з�����Ӧ�Ļ�ѧ����ʽ��
��
��2����ͨ������ȷ�����ƿ�����Ԫ�ص���������Ϊ ��
��֪ʶ�㡿�Ƽ�����������ʡ���������C1 C2
���𰸽����� (1)��2Na+2H2O= 2NaOH+H2����Na2O+H2O = 2NaOH
 ��2Al+2NaOH+2H2O 2NaAlO2+3H2��
��2Al+2NaOH+2H2O 2NaAlO2+3H2��
��2��89%
��������1�����ֱ����������ó�ȥ����Ĥ�������һЩС���������÷���ˮ�У���������ˮ��Ӧ�����������ƣ�����ˮ��Ӧ����������������������������������Һ��Ӧ����ƫ����������������Ӧ���йط���ʽΪ��Na2O+H2O=2NaOH��2Na+2H2O=2NaOH+H2����2Al+2NaOH+2H2O=2NaAlO2+3H2����
(2)n����NaOH��=2.0 L��0.05 mol•L-1=0.1 mol��n(H2)= ��n��NaAlO2��=n��Al��=
��n��NaAlO2��=n��Al��=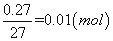 �ɵ����غ�֪��n��Na��+3n��Al��=2n��H2��
�ɵ����غ�֪��n��Na��+3n��Al��=2n��H2��
����n��Na��+3��0.01 mol=2��0.05 mol����ã�n��Na��=0.07 mol��
�����غ�֪��n��NaAlO2��+n��NaOH��=n��Na��+2n��Na2O��
����0.01 mol+0.1 mol=0.07 mol+2n��Na2O����
�ã�n��Na2O��=0.02 mol�����Ը��ƿ�����Ԫ�ص���������Ϊ�� ��
��
��˼·�㲦�����⿼���˻����ķ����ͼ��㣬��Ӧ�϶࣬���̱Ƚϸ��ӣ�����ʱע����غ�ĽǶȼ��㡣


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�����ȫȼ�գ�����CO2��H2O����12 g���л�����ȫȼ�պ�IJ���ͨ��ŨH2SO4��ŨH2SO4����14.4 g����ͨ����ʯ�ң���ʯ������26.4 g�����л������ʽΪ(����)
A��C4H10 B��C2H6O
C��C3H8O D��C2H4O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪AΪ����ɫ���壬T��RΪ���ֳ�������;�ܹ�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬 C����ɫ��ζ�����壬H�ǰ�ɫ���������ڳ�ʪ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���塣
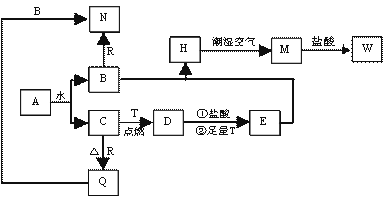
��1��д���������ʵĻ�ѧʽ��
A�� D�� R�� ��
��2����Ҫ��д���з�Ӧ����ʽ��
H�ڳ�ʪ�����б��M�Ĺ����еĻ�ѧ����ʽ�� ��
��N��ͨ����CO2ʱ��Ӧ�����ӷ���ʽ�� ��
D�����ᷴӦ�����ӷ���ʽ�� ��
��3��������������C�ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ��������þ��ͭ�Ͻ���뵽ϡ�����У�����ǡ����ȫ��Ӧ�����跴Ӧ�����л�ԭ����ȫ��NO����������Һ�м������ʵ���Ũ��Ϊ3mol/LNaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1 g���������й���������ȷ����
A.����Ͻ����������Ϊ9.6g
B.������ȫʱ����NaOH��Һ���Ϊ150mL
C.�μӷ�Ӧ����������ʵ���Ϊ0.4mol
D.�ܽ�Ͻ�ʱ����NO�������0.224L���Ա�״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ijЩ��ѧ֪ʶ��ͼ���ʾ�������յ�ֱ�ۡ�������Ч��������ͼ������ʾ�Ļ�ѧ֪ʶ�У�����ȷ���� �� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���һ�����������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20 mL pH��14����Һ��Ȼ����1 mol/L������ζ���������ɳ�������������������������ϵ��ͼ��ʾ��������˵����ȷ����

��A��ԭ�Ͻ�����Ϊ 0.92 g�� B���������������Ϊ896 mL(��״����)
��C��ͼ��m��ֵΪ1.56�� D��ͼ��V2��ֵΪ60
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йؽ�����˵���У���ȷ����
�ٴ������������� �����Ż���ˮ���� ��KSCN��Һ���Լ���Fe3��
��ȱ�ƻ�����������ɣ�ȱ��������ƶѪ ����ͭ������֡�Ӳ�����ǺϽ�
A���٢ۢ� B���ڢۢܢ� C���٢ۢܢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��800 Kʱ����Ӧ��CO(g)��H2O(g)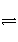
 H2(g)��CO2(g)������ʼŨ��c0(CO)��2 mol��L��1��c0(H2O)��3 mol��L��1����Ӧ�ﵽƽ��ʱ��COת����CO2��ת����Ϊ60%�������H2O�ij�ʼŨ�ȼӴ�Ϊ6 mol��L��1�������ʱCOת��ΪCO2��ת���ʡ�
H2(g)��CO2(g)������ʼŨ��c0(CO)��2 mol��L��1��c0(H2O)��3 mol��L��1����Ӧ�ﵽƽ��ʱ��COת����CO2��ת����Ϊ60%�������H2O�ij�ʼŨ�ȼӴ�Ϊ6 mol��L��1�������ʱCOת��ΪCO2��ת���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���˳��������ȷ����
A���ܶȣ�Na > K > Li B�����ȶ��ԣ�HCl > H2S > H2O
C�����ԣ�H2CO3 < H2SiO3 < HNO3 D�����Ӱ뾶��F -> A13+ > CI –
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com