
利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视.
(1)医学上进行钡餐透视时为什么不用BaCO3? (用离子方程式表示) .
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
A.5mL水;
B.40mL 0.2mol•L-1Ba(OH)2溶液;
C.20mL 0.5mol•L-1Na2SO4溶液;
D.40mL 0.1mol•L-1H2SO4溶液中,溶解至饱和.
①以上各溶液中,Ba2+的浓度由大到小的顺序为 .
A.b>a>c>d B.b>a>d>c
C.a>d>c>b D.a>b>d>c
②已知25℃时,Kap=1.1×10-10,上述条件下,溶液b中的SO42-浓度为 mol•L-1,溶解c中Ba2+的浓度为 mol•L-1.
③某同学取同体积的溶液b和溶液d直接混合,则混合液的pH为 (设混合溶液的体积为混合前两溶液的体积之和)
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
其他条件不变,升高温度下列数据不一定增大的是( )
A.可逆反应的化学平衡常数K B.0.1 mol/L CH3COONa溶液的pH
C.水的离子积常数KW D.弱电解质的电离程度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) / mol·L-1 | 混合溶液的pH |
甲 | c(HX)=0.1 mol·L-1 | 0.1 | pH = 10 |
乙 | c(HY)=0.1 mol·L-1 | 0.1 | pH = 7 |
丙 | c(HZ)=0.1 mol·L-1 | 0.1 | pH = 9 |
(1)根据表中数据比较HX、HY、HZ三种酸的酸性由强到弱的顺序为_________,丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-)= mol·L-1。
(2)部分实验反应过程中的pH变化曲线如下图:
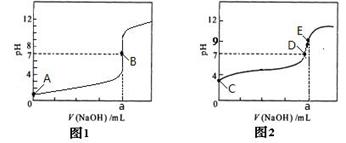
①表示乙组实验的pH变化曲线是________________(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是________________。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性。
①浓度为1.0×10-3 mol·L-1的氨水b L
②c(OH-)=1.0×10-3 mol·L-1的氨水c L
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d的大小关系是_________________。
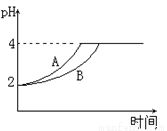
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是__________(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1__________m2(填“<”、“=”、“>”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
某密闭容器中发生反应:X(g)+3Y(g) 2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
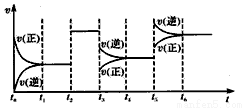
A.t2时加入了催化剂 B.T3时平衡的移动可使化学平衡常数减小
C.t5时增大了压强 D.T6时达到平衡后反应物的转化率最大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。已知0.5molN2H4(g)完全燃烧生成氨气和气态水时,放出267kJ热量.则下列热化学方程中正确的是
A.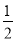 N2H4(g)+
N2H4(g)+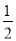 O2(g)=
O2(g)=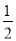 N2(g)+H2O(g) △H=+267kJ/mol
N2(g)+H2O(g) △H=+267kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ/mol
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是
A.20 mL 2 mol/L FeCl3溶液 B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液 D.40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
在25℃时,将amol/L的氨水与0.01mol/L的HCl溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)
A.溶液中c(NH4+)=c(Cl-)
B.此时水的电离程度最大
C.此时溶液中NH3·H2O的物质的量浓度为1/2[(a-0.01)]mol/L
D.用含a 的代数式 NH3·H2O的电离平衡常数Kb=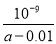 (mol/L)
(mol/L)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
Ⅰ.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将_________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将_______________。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g) △H<0的影响.
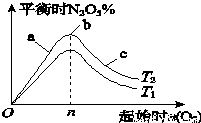
(1)图象中T1和T2的关系是T1_________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是_________(填字母);
(3)若容器体积为1L,n=1mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=_________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
已知常温下浓度均为0.1mol/L的下列三种溶液的PH:
溶质 | NaHCO3 | Na2CO3 | NaCN |
PH | 9.7 | 11.6 | 11.1 |
下列说法中正确的是
A.溶液中阳离子的物质的量浓度之和:Na 2CO3 >NaCN>NaHCO3
B.相同条件下的酸性:H 2CO3 <HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na 2CO3 溶液的温度, 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com