
| A. | 金属钠保存在煤油中 | |
| B. | 白磷保存在水中 | |
| C. | 在FeCl3 溶液中加入一定量铁粉,防止溶液变质 | |
| D. | 为了检验FeCl2溶液是否变质,可用KSCN 溶液检验 |
分析 A.钠能与空气中的水和氧气反应;
B.白磷着火点低,在空气中易自燃;
C.加入一定量的铁粉,铁与铁离子反应;
D.先考虑如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色.
解答 解:A.钠能与空气中的水和氧气反应,又钠的密度比水略小,故钠保存在煤油中,或用石蜡密封保存,故A正确;
B.白磷着火点低,在空气中易自燃,放在冷水中可使之与氧气隔绝,并降低其表面温度,因此其密封保存与空气中的氧气有关,故B正确;
C.加入一定量的铁粉,铁与铁离子反应,溶液中Fe3+浓度降低,故C错误;
D.如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故D正确.
故选C.
点评 本题考查药品的储存和离子的检验,难度不大,解题的关键是了解所储存物质的特性,注意检验Fe3+的物质有:KSCN(溶液变血红色)、苯酚(溶液呈紫色),题目难度不大.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 用Al作电极电解NaHCO3溶液:2Al+6H2O═2Al(OH)3↓+3H2↑ | |
| B. | 向明矾溶液中加入氢氧化钡溶液至沉淀质量最大时:2Al3++2SO42-+2Ba2++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| C. | 碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O | |
| D. | 酸性高锰酸钾溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在恒温恒容 密闭容器中,能说明反应:2N02(g)
密闭容器中,能说明反应:2N02(g) 2NO(g)+02(g)达到平衡
2NO(g)+02(g)达到平衡 状态的是 ( )
状态的是 ( )
①单位时间内生成nmol O2的同时生成2nmol NO2;②单位时间内生成nmol O2的同时生成2nmol N0;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态。
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | O=O |
| 键能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1.2NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为0.6mol•L-1 | |
| B. | Na在空气中长期放置变成Na2CO3粉末 | |
| C. | 过量的澄清石灰水分别与Na2CO3溶液和NaHCO3溶液反应,现象不同 | |
| D. | 滴加KSCN显红色的溶液中可大量存在NH4+、K+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
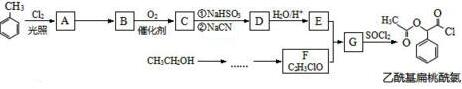
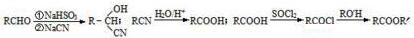
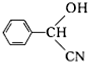 .
.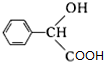 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +nH2O.
+nH2O.查看答案和解析>>
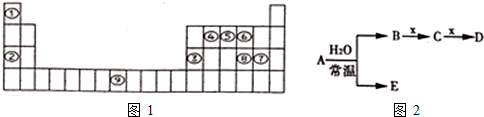
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲<乙,简单阴离子的半径:丙>丁>戊 | |
| B. | 非金属性:乙<丁 | |
| C. | 最高价氧化物对应的水化物的酸性:丙<丁 | |
| D. | 气态氢化物的稳定性:丙>丁>戊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com