
����Ŀ��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2����֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2��
(1)�÷�Ӧ�еĻ�ԭ����____________��
(2)�÷�Ӧ�У�������ԭ��Ӧ�Ĺ�����______________��______________��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ��������ת�Ƶķ������Ŀ��__________��
(4)����Ӧת����0.3 mol���ӣ�������������ڱ�״�������Ϊ__________L��
���𰸡�H2O2 H2CrO4Cr(OH)3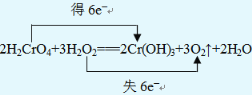 3.36
3.36
��������
��1������ϢH2O2��O2�п�֪��OԪ�صĻ��ϼ���-1�����ߵ�0����H2O2Ϊ��ԭ�����������������������H2O2��
��2��������������ԭ��Ӧ������Ԫ�ػ��ϼ۽��͵�����Ϊ����������CrԪ�صĻ��ϼ۽��ͣ�����ԭ��Ӧ�Ĺ���ΪH2CrO4��Cr��OH��3���������������������� H2CrO4��Cr��OH��3��
��3����Ӧ��H2O2�е�OԪ��ʧ���ӣ�H2CrO4�е�CrԪ�صõ����ӣ�2molH2CrO4��Ӧת�Ƶ���Ϊ2mol����6-3��=6mol������˫���ŷ��������ת�Ƶķ������ĿΪ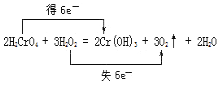 ����������������������
���������������������� 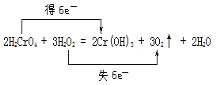 ��
��
��4����2H2CrO4+3H2O2�T2Cr��OH��3��+3O2��+2H2O ��Ӧ��֪������3mol����ת��6mol���ӣ���ת����0.3mol���ӣ����������������ʵ���Ϊ0.3/6��3mol=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L�������������������ǣ�3.36L��


 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�Ҫǿ���й���������Ҫ�ã�������ǿ��Ƽ������ҹ������ش�Ƽ��л� ŵ���������ǣ� ��
A | B | C | D |
|
|
|
|
����������DZˮ�� ʵ��ɹ� | �״��˹��� �ɽᾧ ţ�ȵ��� | ��°������� �Ƽ | ���������ƿ�ű��ҩ-������ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������һ����ȷ����
A. 1molFe�����ˮ������Ӧ��ת�Ƶ��ӵ���ĿΪ3NA
B. ��״���£�2.24LHF�к��еļ��Լ���ĿΪ0.1NA
C. 5mL0.1mol/LCH3COOH��Һ��10mL0.5mol/LCH3COOH��Һ������CH3COOH���������
D. һ�������£���0.1L������ͨ��4.6gNO2���壬NO2�����ʵ���Ũ��С��1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��ص������кܶ࣬����һ�־������õ���ʵ�Ũ�Ȳ�ɡ�Ũ���ء������������ij���ӵ�Ũ��Խ��ʱ�������Ի�ԭ��Խǿ����ͼ���׳�Ϊ3mol��L-1��AgNO3��Һ���ҳ�Ϊ1mol��L-1��AgNO3��Һ��A��B��ΪAg�缫��ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1�����ֵ�����ָ�뷢��ƫת������˵������ȷ����

A. һ��ʱ��������ָ�뽫���㣬��ʱ����Ϊ��Ӧ���ٽ���
B. ��������ָ�����պ�K1���Ͽ�K2���ҳ���ҺŨ������
C. ��������ָ�����պ�K1���Ͽ�K2������Ag�缫��������
D. ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1����ʱNO3-��B�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����N2�����õķ�Ӧ��NaNO2+NH4Cl![]() NaCl+N2��+2H2O�����ڸ÷�Ӧ��˵����ȷ����
NaCl+N2��+2H2O�����ڸ÷�Ӧ��˵����ȷ����
A. NaNO2����������Ӧ
B. ����1 mol N2ʱת�Ƶĵ�����Ϊ6 mol
C. NH4Cl�еĵ�Ԫ�ر���ԭ
D. �������ͱ���ԭ��Ԫ����ͬһ��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ȷ���ǣ� ��
ѡ�� | ���� | �� | �� | ���� |
A | ˮ�� | ���� | ���� | ��������Һ |
B | ��ˮ | ���� | �ռ� | �� |
C | C60 | ���� | ��ʯ�� | �� |
D | ���� | ̼�� | ������ͭ | ������������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ˮ�к��е�NH4+��һ�������¿ɱ�O2��������Ӧ�������£�
��NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ��H =-273kL/mol
��NO2-(aq)+l/2O2(g)=NO3-(aq) ��H =-73kL/mol
������������ȷ����
A. lmol��NH3��1mol��NH4+����10��6.02��1023������
B. �����£�0.1mol/LHNO2(aq) pH>l����NaNO2��Һ�Լ���
C. NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ��H =-346kL/mol
D. ����������ת�������У���ˮ������������Ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڻ�����������ˮ����������Ӧ�ù㷺��
��1��ú�ƵõĻ���ԭ�����к����ʻ���(O=C=S)�������ʿ�ת��ΪH2S����Ҫ��Ӧ���£�
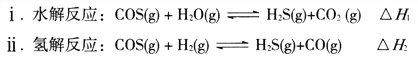
��֪��Ӧ����صĻ�ѧ�������������±���
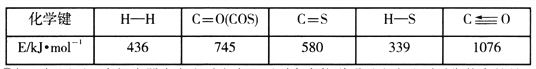
��һ�������£��ܱ������з�����Ӧi������COS(g)��ƽ��ת����(![]() )���¶�(T)�Ĺ�ϵ��ͼ��ʾ����A��B��C�����Ӧ��״̬�У�v(COS)=v(H2S)����____________��(����)
)���¶�(T)�Ĺ�ϵ��ͼ��ʾ����A��B��C�����Ӧ��״̬�У�v(COS)=v(H2S)����____________��(����)
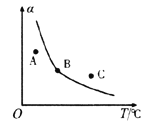
����Ӧii�������淴Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ��ʾ�����б�ʾ�淴Ӧ��ƽ�ⳣ��(K��)����__________(����A������B��)��T1��ʱ�����ݻ�Ϊ10 L�ĺ����ܱ������г���2 mol COS(g)��1 mol H2(g)��������Ӧii��COS��ƽ��ת����Ϊ_____________��
��2������������һ��ǿ�������ᣬ��ṹʽΪ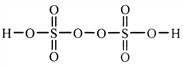
����Ag+�������£�S2O82-����Mn2+��ˮ��Һ�з�����Ӧ����SO42-��MnO4-���÷�Ӧ�����ӷ���ʽΪ________________________��
�ڹ�ҵ�Ͽ��ö��Ե缫������������炙����Һ�ķ����Ʊ���������李��ܷ�Ӧ�����ӷ���ʽΪ________________________________��
��3��NaHS��������ˮ�����ij���������֪��25��ʱ����ӦHg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)��ƽ�ⳣ��K=1.75��1038��H2S�ĵ���ƽ�ⳣ��Ka1=1.0��10-7��Ka2=7.0��10-15��
HgS(s)+H+(aq)��ƽ�ⳣ��K=1.75��1038��H2S�ĵ���ƽ�ⳣ��Ka1=1.0��10-7��Ka2=7.0��10-15��
��NaHS�ĵ���ʽΪ____________________����Ksp(HgS)=_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20��ʱ,��H2C2O4��NaOH�����Һ�У�c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L����̼Ԫ�����ķֲ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷȷ��
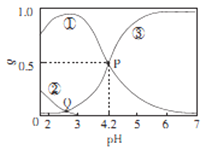
A. �ٱ�ʾH2C2O4�ķֲ����ߣ��۱�ʾC2O42-�ķֲ�����
B. 20��ʱ��H2C2O4�Ķ�������ƽ�ⳣ��Ka=1��10-4.2
C. Q���Ӧ��Һ��lgc(H+)<lgc(OH-)
D. 0.100mol/L��NaHC204��Һ��:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com