试剂:盐酸、CH
3COOH溶液、NaOH溶液、NaCl溶液、氨水。
仪器:250mL烧杯(5只)、灯泡(5只)、导线、电极、电源。
【实验步骤】
1. 在5只250mL烧杯中分别加入浓度相同的盐酸、CH
3COOH溶液、NaOH溶液、NaCl溶液、氨水各150mL。
2. 在5种溶液中分别放入相同规格的石墨电极,按下图连接好。
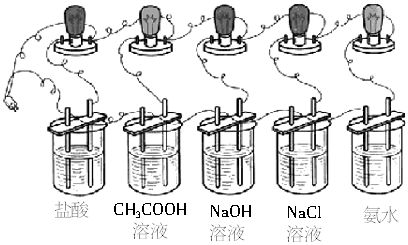
3. 接通电源,仔细观察现象。
现象1:五个灯泡都亮起来。
结论1:______________________________。
现象2:盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,醋酸、氨水对应的灯泡较暗。
结论2:______________________________。
【思考】
1. 本实验成功的关键在于 ______________。
2. 小明同学根据现象2得出一个结论:氯化氢、氯化钠、氢氧化钠是强电解质,醋酸、一水合氨是弱电解质。你同意他这个观点吗?为什么?
____________________________________。
3. 小红同学在实验的基础上,进一步查阅资料得知:一般来说,强酸、强碱和大部分盐是强电解质,弱酸、弱碱是弱电解质。你同意她这个观点吗?
____________________________________。


 已知:Ki1(H2CO3)>Ki1(H2S).现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用如图所示装置进行下列实验,无法达到实验目的是( )
已知:Ki1(H2CO3)>Ki1(H2S).现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用如图所示装置进行下列实验,无法达到实验目的是( )