
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
分析 平衡移动列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用平衡移动原理时,该反应必须是可逆反应,否则不适用平衡移动原理.
解答 解:A、加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可用平衡移动原理解释,故A不符合;
B、钢铁在潮湿的空气中容易生锈,是铁的吸氧腐蚀,原电池反应,不能用平衡移动原理来解释,故B符合;
C、工业上合成氨的反应是放热反应,高温是为了加快反应速率,不利于提高产物氨气的产率,能用平衡移动原理来解释,故C不符合;
D、将1mLpH=3的醋酸溶液加水稀释至l00mL,促进醋酸的电离,所以测得其pH<5,能用平衡移动原理来解释,故D不符合;
故选B.
点评 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
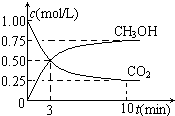 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞开放置久了的浓硫酸进行配制 | B. | 量取浓硫酸仰视刻度线 | ||
| C. | 配制过程中未洗涤烧杯和玻璃棒 | D. | 配制前,容量瓶有少许蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
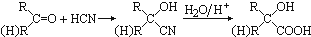 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: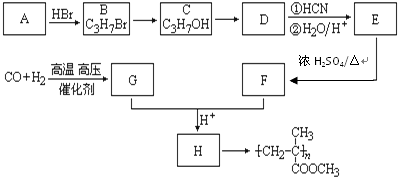
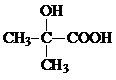 ;
; ;
;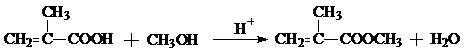 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应选用100mL容量瓶 | |
| B. | 配置之前容量瓶中残留的蒸馏水会导致浓度偏高 | |
| C. | 定容时腐蚀刻度会导致浓度偏低 | |
| D. | 摇匀、静置后发现凹液面低于刻度线,再加水至刻度线即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com