
【题目】浓硫酸在下列反应中,既表现出氧化性,又表现出酸性的是
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
③2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O
④Fe2O3+3H2SO4Fe2(SO4)3+3H2O
A. ①② B. ②③
C. ①③ D. ③④
【答案】C
【解析】
若反应中浓硫酸既表现出氧化性,又表现出酸性,则说明该反应中部分H2SO4分子中元素得电子,化合价降低,另一部分H2SO4中元素化合价不变,据此分析作答。
①参与反应的2 mol H2SO4分子中含2 mol S,其中1 mol S化合价从+6价降低到+4价,被还原,做氧化剂,另1 mol S化合价保持不变,形成CuSO4,故①正确;
②参与反应的2 mol H2SO4分子中+6价的S全部转化为+4价,因此,该反应中浓硫酸只表现氧化性,故②错误;
③参加反应的4 mol H2SO4分子中,有1 mol S从+6价降低到+4价,剩余3 mol以Fe2(SO4)3形式存在,其元素化合价均未改变,故③正确;
④该反应无元素化合价的变化,不是氧化还原反应,浓硫酸只表现出酸性,故④错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为![]() 的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③______⑥(填>、=、<),溶液中的离子浓度由大到小的顺序为________________。
(2)将等体积的①、⑤混合,则溶液的pH______7(填>、=、<),用离子方程式说明其原因____________________。
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____________,最终产生![]() 总量的关系为__________。
总量的关系为__________。
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的![]() 溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤_______⑥(填>、=、<)。
(6)将等体积的②、⑤混合,则溶液中浓度最大的离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】江苏正在建设世界最大的海上风电场,防腐蚀是海上风电的突出问题,下列说法正确的是
A. 海水的pH一般在8.0~8.5,对风电钢铁支架的腐蚀主要是析氢腐蚀
B. 腐蚀总反应为4Fe+3O2+2xH2O==2[Fe2O3·xH2O](铁锈)的△H<0,△S<0
C. 钢部件镀锌前,可用碱液洗去表面的铁锈
D. 热喷涂锌铝合金,可以减缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 凡能发生银镜反应的有机物一定是醛
B. 在氧气中燃烧时只生成CO2和H2O的物质一定是烃
C. 苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸
D. 75%(体积分数)的乙醇溶液常用于医疗消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关氨及铵盐的叙述中,不正确的是
A. 铵盐是农业上常用的化肥
B. 氨的喷泉实验体现了氨的溶解性和氧化性
C. 实验室里常用固体氯化铵与氢氧化钙反应制取少量氨气
D. 氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数∮(X)随pH的变化如图所示[已知:∮(X)=  ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A. pH=1.2时,c(H2A)=c(HA-) B. lg[K2(H2A)]=-4.2
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-) D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三个体积相同的密闭容器,按下图所示投料,并在T℃条件下开始反应,其中容器I保持恒压100kPa。已知:分压=总压×物质的量分数,对于2NO2(g)![]() N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是
N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是

A. 达平衡时,容器Ⅱ中N2O4转化率小于50%
B. 达平衡时,容器Ⅰ中N2O4分压比容器Ⅲ中的大
C. 达平衡时,容器Ⅰ中N2O4的体积分数比容器Ⅱ中的大
D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业纯碱中常含NaCl,某活动小组设计如图装置测定工业纯碱中Na2CO3的含量。
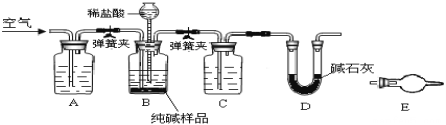
(1)检验装置B气密性方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量水,使漏斗内水面高于瓶内水面,停止加水后,若___________,说明装置不漏气。
(2)装置A的作用是_______,装置C中的试剂为_______。
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?_______(选填“必要”或“不必要”),判断的理由是_____________________。
(4)实验前28.8g样品,实验后测得D装置增重8.8g,则样品中Na2CO3质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com