
����Ŀ��KAl(SO4)2��12H2O(����)��һ�ָ��Σ�����ֽ�ȷ���Ӧ�ù㷺��ʵ�����У����÷�������( ��Ҫ�ɷ�ΪAl������������Fe��Mg����)�Ʊ������Ĺ�������ͼ��ʾ���ش���������:
![]()
(1)��д����(����ͬ����ĵ�������Ԫ��)��ԭ�ӽṹʾ��ͼ_________��
(2)Ϊ��������������,�Լ���Ӧѡ��______(����)��������______________��
A.HCl��Һ B.H2SO4 ��Һ C.��ˮ D.NaOH��Һ
(3)����B�Ļ�ѧʽΪ________����������������ˮ����Һ�������ԣ���ԭ����________(�����ӷ���ʽ��ʾ)��
(4)��ѧ�о�֤��NaAlO2 ��ˮ��Һ��ʵ������Na[Al(OH)4](���ǻ���������)���������ܽ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ___________________��
(5)�����£���pH��NaAlO2 ��NaOH������Һ�У���ˮ�������c(OH-)ǰ��Ϊ���ߵ�108������������Һ��pH=__________��
(6)��֪�����£�Kw=10��10-14��Al(OH)3![]() AlO2-+H++H2O K=2.0��10-13��Al(OH)3����NaOH��Һ��Ӧ��ƽ�ⳣ������_________��
AlO2-+H++H2O K=2.0��10-13��Al(OH)3����NaOH��Һ��Ӧ��ƽ�ⳣ������_________��
���𰸡�  D ����������Ҫ�ɷ�Al����ǿ����Һ��Ӧ��������Fe��Mg���� Al(OH)3 Al3++3H2O=Al(OH)3+3H+ 2A1+2NaOH+6H2O=2Na[Al(OH)4] +3H2�� 11 20
D ����������Ҫ�ɷ�Al����ǿ����Һ��Ӧ��������Fe��Mg���� Al(OH)3 Al3++3H2O=Al(OH)3+3H+ 2A1+2NaOH+6H2O=2Na[Al(OH)4] +3H2�� 11 20
����������1����������ͬ����ĵ�������Ԫ�أ�������ԭ��������13+18=31���������3�����ӣ���ԭ�ӽṹʾ��ͼΪ�� ��
��
��2������������Ҫ�ɷ�Al����ǿ���ǿ����Һ��Ӧ��������Fe��Mgֻ���ܽ���ǿ������Һ�У���ѡ��NaOH��Һ�ܽ������ޣ��ɳ�ȥ���е�Fe��Mg�����ʡ�
��3����Һ�м���NH4HCO3��Һ��NH4+��AlO2-����˫ˮ�⣺NH4++AlO2-+2H2O=Al(OH)3��+NH3H2O��AlO2-��HCO3-Ҳ���ܴ������棺AlO2-+HCO3-+H2O=Al(OH)3��+CO32-��������Ӧ������Al(OH)3��������������������ˮ����ΪAl3+ˮ�⣺Al3++3H2O![]() Al(OH)3+3H+��������ˮ��Һ�����ԡ�
Al(OH)3+3H+��������ˮ��Һ�����ԡ�
��4���������ܽ��������Ҫ����Al��NaOH��Һ�ķ�Ӧ����NaAlO2��������2Al+2NaOH+2H2O=2NaAlO2+3H2������NaAlO2��ʾΪNa[Al(OH)4]������������ʽ��ʾΪ��2A1+2NaOH+6H2O=2Na[Al(OH)4]+3H2����
��5��NaAlO2��Һ��ˮ�ĵ��뱻�ٽ�����NaOH��Һ��ˮ�ĵ��������ơ�������Һ��pH=a����NaAlO2��Һ��ˮ�������c(OH-)=10-(14-a)molL-1��NaOH��Һ��ˮ�������c(OH-)=c(H+)=10-amolL-1������֪10-(14-a)��10-a��108�����a��11��
��6��Al(OH)3����NaOH��Һ��ӦΪ��Al(OH)3+OH-=AlO2-+2H2O��ƽ�ⳣ��K= =
= =
=![]() =20��
=20��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1molX��1molY���з�Ӧ��2X��g��+Y��g��Z��g������60s�ﵽƽ�⣬����0.3mol Z��������ȷ���ǣ� ��
A.60s����XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol/��L?s��
B.�����������Ϊ20L��Z��ƽ��Ũ�ȱ�Ϊԭ���� ![]()
C.������ѹǿ��������Y��ת���ʼ�С
D.�������¶ȣ�X���������������÷�Ӧ������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����̼��������̼�����þ���ʮ����Ҫ�����壬��ѧ��������¼������룺
��.������̼�������ڴ��������¿���ȡ��̼ϩ������һ�����ܱ������зֱ�Ͷ��1molCO2��3molH2��������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H���ڲ�ͬ�¶��£��ô��м������ƽ��ʱH2�����ʵ����仯��ϵ��ͼ��ʾ��
C2H4(g)+4H2O(g) ��H���ڲ�ͬ�¶��£��ô��м������ƽ��ʱH2�����ʵ����仯��ϵ��ͼ��ʾ��
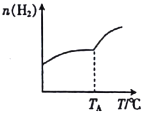
��1�������������䣬��ʼʱ����1molCO2��2molH2����Ͷ�ϣ���CO2��ת���ʽ�____________(����� ��С�����䡱)��
��2����H____________ (�>����<������ȷ����)0��
��3������������ϵ���������������Խ��ͼʾ�ƶ����ȶ��ԣ�C2H4_______(�>�� ��<������ȷ����)H2O��
��.�״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�Ʊ��״����йط�Ӧ�Ļ�ѧ����ʽ�Լ��ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ |
| 500 | 700 | 800 |
��2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
��3H2(g)+CO2 (g) | K3 |
��ش��������⣺
��4�����ݷ�Ӧ�Ƚϡ�H1__________(�>���� <����ȷ����)��H2��
��5��500��ʱ��÷�Ӧ����ijʱ��H2(g)��CO2
��6�����д�ʩ��ʹ��Ӧ�۵�ƽ����ϵ��![]() �������___________(����ĸ)��
�������___________(����ĸ)��
A.��H2O(g)����ϵ�з����ȥ B.����He(g)��ʹ��ϵѹǿ����
C.�����¶� D.�ٳ���1molH2
��.��7���������뽫CO�����з�Ӧ��ȥ:2CO(g)=2C(s)+O2(g)����������������ܷ�ʵ��?_______________(��ܡ����ܡ�)��������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ȼ��仯�����˵������ȷ����
A. �������������ʹ�ʻ���ɫ
B. �����������а�����ȼ�գ�������ɫ���棬����������ˮ���Ƶ�����
C. Ư�۵���Ҫ�ɷ�ΪCaCl2��Ca(ClO)2����Ч�ɷ�Ϊ����
D. ������ˮ�к���HClO������Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������¾���ͬ�Ļ�ѧ��Ӧ������ʵ��ͼʾ�仯��AΪ��ʽ�Σ�BΪ��ɫ��ζ���壻��ɫ����D��ʹ��ɫʯ����ֽ������X��F��YΪ���嵥�ʣ���YΪ��ɫ���壬FΪ��������Ҫ�ɷ�֮һ��GΪ���Σ�G����ɫ����M����Һ�пɷ�Ӧ����B����Ӧ���dz�����ҵԭ���� 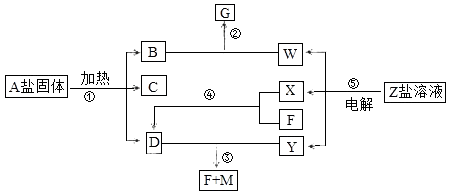
��1��д���������ʵĻ�ѧʽ��A��Y
��2��д����Ӧ�ڵ����ӷ���ʽ ��
��3��д����Ӧ�۵Ļ�ѧ����ʽ ��
��4��������pH=10�������Ϊ100mL��D��W����Һ��M��Ӧ�����ĵ�M�����ʵ�����ϵDW������ڡ���С�ڡ����ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ҩ��H��һ�ֿ���������������ҩ��,��ϳ�·����ͼ��ʾ:

��֪:
��1�� E�ķ���ʽΪC9H8O2����ʹ������Ȼ�̼��Һ��ɫ
��2�� H�Ľṹ��ʽΪ
��3�� RCOOH![]() ��R������
��R������
��4�� 
��ش���������:
��1��A�ı�������____�ֲ�ͬ��ѧ��������ԭ�ӡ�
��2���ܵķ�Ӧ������________�÷�Ӧ��������_______��l molH�����Ժ�____mol NaOH ��Ӧ��
��3��G�Ľṹ��ʽΪ__________��
��4��D��һ�������¿��Ծۺ��γɸ߷��ӣ�д���÷�Ӧ�Ļ�ѧ����ʽ__________��
��5��E�ж���ͬ���칹�壬ͬʱ��������������E�Һ��б�����ͬ���칹����_____�֡�
���ܷ���������Ӧ ���ܷ���ˮ�ⷴӦ �۷����к��Ļ�ֻ�б���
��6������H�������ϳ�·�ߣ����һ������ȩ��NH2CH(CH3)2 Ϊ��ʼԭ���Ʊ�ҽҩ�м���CH3CONHCH(CH3)2�ĺϳ�·��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO47H2O�����ᷨ����һ��ϡ�н�����Ʒ�����в����ĸ���Ʒ����Ʒ���Ϊ����ɫ����ɫ�ᾧ���壮���������ɵ��ڼ���ˮ�е�pH����ˮ���������л���ϣ������ٳ�������ҪӦ����ˮ�ʾ�����ҵ��ˮ������ͬʱ����ɱ�����ã�
��1��98% 1.84g/cm3��Ũ������ϡ�����У��ܶ��½�����ϡ����50%ʱ���ܶ�Ϊ1.4g/cm3 �� 50%���������ʵ���Ũ��Ϊ��������λС������50%��������30%������������ϣ�������Ũ��Ϊ���������=����40%����
��2��ʵ��������20%�������ᣨ100�˷������ẬSO320�ˣ�����ϡ���ᣬ����SO3nH2O��ʾ20%�ķ������ᣬ��n=��������λС������
��3���̷��ڿ��������ױ���������Ϊ����������ȡ7.32�˾�������ϡ�������������BaCl2��Һ�����˵ó���9.32�ˣ���ͨ��112mL����״��������ǡ�ý�Fe2+��ȫ�������Ʋ⾧��Ļ�ѧʽΪ ��
��4�����������[��NH4��2SO4FeSO46H2O]���׳�Ī���Σ������̷��ȶ����ڷ�����ѧ�г���������Fe2+�ı���Һ���ô�Fe2+�ı���Һ���Բⶨʣ��ϡ�����������ȡ8.64��Cu2S��CuS�Ļ������200mL 2mol/Lϡ������Һ������������Ӧ���£� 10NO3��+3Cu2S+16H+=6Cu2++10NO��+3SO42��+8H2O
8NO3��+3CuS+8H+=3Cu2++3SO42��+8NO��+4H2O
ʣ���ϡ����ǡ����V mL 2mol/L ��NH4��2Fe��SO4��2��Һ��ȫ��Ӧ��
��֪��NO3��+3Fe2++4H+=NO��+3Fe3++2H2O
��Vֵ��Χ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L 1mol/L ��NaOH��Һ����0.8mol CO2 ����������Һ��̼�����̼����������ʵ�����Ũ��֮��ԼΪ
A. 1��3 B. 2��1 C. 2��3 D. 3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����Ϊ2L���ܱ������м���1molCO2��3molH2���������µķ�Ӧ��
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) ��H��0��
CH3OH(g) +H2O(g) ��H��0��
���϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���ǣ� ��
A��������CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1 ��1
B��v��(CO2)��3v��(H2)
C�������ڻ������ƽ����Է����������ֲ���
D��������CO2��H2��CH3OH��H2O�����ʵ���Ũ�ȶ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com