
分析 浓硫酸具有吸水性,钠离子增重5.4g为水的质量,则n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=2n(H2O)=2×0.3mol=0.6mol,生成物通入KOH溶液,增重的19.8g质量为二氧化碳的质量,则n(CO2)=$\frac{19.8g}{44g/mol}$=0.45mol,n(C)=n(CO2)=0.45mol,故苯的同系物A分子中C、H原子数目之比为0.45mol:0.6mol=3:4,令A的分子式为CnH2n-6,则n:(2n-6)=3:4,解得n=9,故A的分子式为C9H12,若A的核磁共振氢谱中只有2种峰,则A为均三甲苯,据此进行解答.
解答 解:(1)浓硫酸具有吸水性,钠离子增重5.4g为水的质量,则n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=2n(H2O)=2×0.3mol=0.6mol,生成物通入KOH溶液,增重的19.8g质量为二氧化碳的质量,则n(CO2)=$\frac{19.8g}{44g/mol}$=0.45mol,n(C)=n(CO2)=0.45mol,故苯的同系物A分子中C、H原子数目之比为0.45mol:0.6mol=3:4,令A的分子式为CnH2n-6,则n:(2n-6)=3:4,解得n=9,故A的分子式为C9H12,
答:A的分子式为C9H12;
(2)若A的核磁共振氢谱中只有2种峰,则有两种氢,为均三甲苯,其结构简式为: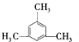 ,
,
答:A的结构简式为 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意计算A分子中C、H原子数目关系,再利用苯的同系物组成通式解答,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
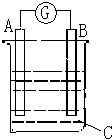 请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,
请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
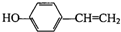 ,其含氧官能团的名称为羟基;
,其含氧官能团的名称为羟基;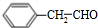 ;
; +NaOH→
+NaOH→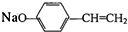 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| a | |||||||
| b | c | d | |||||
| e | f | g |
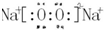 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
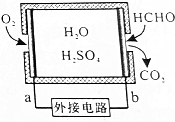
| A. | b为电池负极,甲醛被氧化 | |
| B. | a极的电极反应为O2+4e-+4H+=2H2O | |
| C. | 传感器工作过程中,电解质溶液中硫酸的浓度不变 | |
| D. | 当电路中转移1×10-4mol电子时,传感器内参加反应的HCHO为0.75mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体直接通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 除去溴水中的少量溴化钠 | 加入乙醇,震荡,静置,分液,取出上层液体 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com