
| A、H | B、Be | C、Mg | D、Al |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4 第一电离能最大的是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能(kJ?mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
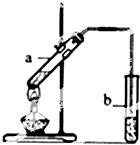 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
- 3 |
- 4 |
A、肯定有Al3+、Mg2+、Cl-,可能有NH
| ||||||||
B、肯定有Al3+、K+、Cl-,肯定没有MnO
| ||||||||
C、肯定有Al3+、Cl-,一定没有HCO
| ||||||||
| D、该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
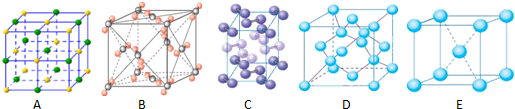
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、在熔融状态下,lmol NaHSO4完全电离出的阳离子数为2NA |
| C、5.6 g铁粉在2.24L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D、78g Na2O2固体与H2O完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
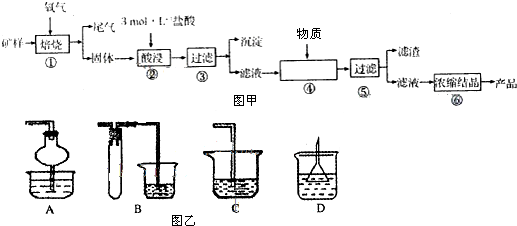
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若向该溶液中加入足量的NaOH溶液,充分反应后过滤、洗涤、灼烧,最终所得固体质量为72g |
| B、若向该溶液中加入过量的稀H2SO4,产生的气体遇空气能变成红棕色 |
| C、若向该溶液中加入过量的稀H2SO4和KSCN溶液,溶液不显血红色 |
| D、该溶液中所含的离子是:Fe2+、Ba2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com