
【题目】W,X,Y,Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
【答案】B
【解析】解:由题设可判定W为Cl,X为F,Y为Al,Z为Na.
A.同周期元素从左到右金属性逐渐减弱,则金属性Na>Al,故A错误;
B.氢化物沸点HF>HCl,因HF分子间存在氢键,故B正确;
C.非金属性F>Cl,则离子还原性Cl﹣>F﹣ , 故C错误;
D.同周期元素原子半径从左到右逐渐减小,则原子半径Na>Al>F,离子半径F﹣>Na+>Al3+ , 故D错误.
故选B.
W的最外层电子数与核外电子总数之比为7:17,应为Cl元素,X与W同主族,则X为F元素,Y的原子序数是W和X的原子序数之和的一半,则原子序数为 ![]() =13,为Al元素,含Z元素的物质焰色反应为黄色,则Z应为Na元素,结合元素的金属性和非金属性的递变规律解答该题.
=13,为Al元素,含Z元素的物质焰色反应为黄色,则Z应为Na元素,结合元素的金属性和非金属性的递变规律解答该题.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知X(g) + 4Y(g) ![]() 2Z(g) ΔH = -a kJ·mol-1(a > 0)。一定条件下将1 mol X 和4 mol Y通入2 L的恒容密闭容器中,反应10 min时,测得Y的物质的量为3.2 mol。下列说法正确的是( )
2Z(g) ΔH = -a kJ·mol-1(a > 0)。一定条件下将1 mol X 和4 mol Y通入2 L的恒容密闭容器中,反应10 min时,测得Y的物质的量为3.2 mol。下列说法正确的是( )
A. 在10 min内,X和Y反应放出的热量为0.4a kJ
B. 在10 min时,Y和Z的物质的量之比为2 : 1
C. 升髙反应温度,逆反应速率增大,正反应速率减小
D. 达到平衡状态时,X、Y的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | … |
A.C6H12B.C6H14C.C7H12D.C7H14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黄铜矿样品标注显示:主要成分为CuFeS2,其余多为脉石(SiO2)。为检验该黄铜矿中的成份,设计了如下实验:


已知:①在空气存在下煅烧黄铜矿,生成Cu、Fe3O4和SO2气体。
②亚硫酸易被氧化:2H2SO3 + O2 = 2H2SO4
请回答下列问题:
(1)该实验装置组装完成后首先应进行的操作是:__________________。
(2)请指出该装置的一个不足之处:___________________。
(3)请设计一个实验方案,证明C中含有SO2和SO42-___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论错误的是( ) 
A.反应开始2 min内平均反应速率最大
B.反应4~6 min内平均反应速率最小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min间生成CO2的平均反应速率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下A可以发生加聚反应,形成高分子化合物E。

(1)E __________________(填“能”或“不能”)使酸性KMnO4溶液褪色。
(2)D分子中的官能团名称是__________________ 。
(3)请写出B和CuO加热生成C的化学方程式:__________________ 。
(4)下列说法正确的是__________________(填序号)
A.乙酸乙酯在冷的饱和纯碱溶液中的溶解度较小,但是热的纯碱溶液比较容易除去乙酸乙酯这类酯类油污
B.C常温下是一种无色、无味,水溶性很好的液体
C.分别取相同质量的C和D,完全燃烧,耗氧量相同
D.反应②和④的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当运动员肌肉受伤时,队医会随即对准运动员的受伤部位喷射药剂氯乙烷,进行局部冷冻麻醉处理.
(1)制取氯乙烷 (CH3CH2Cl)的最好的方法是 .
a.乙烷与氯气发生取代反应 b.乙烯与氯气发生加成反应
c.乙烷与氯化氢反应 d.乙烯与氯化氢发生加成反应
(2)写出所选反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
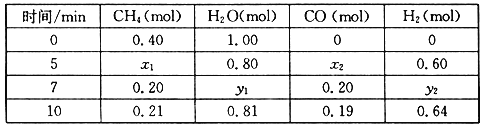
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com