
| A. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 氯气和水反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| C. | 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
分析 A,二者反应生成碳酸钠和水;
B.次氯酸为弱酸,应保留化学式;
C.二者反应生成氢氧化铁沉淀和氯化铵;
D.二氧化硅与氢氧化钠反应生成硅酸钠和水.
解答 解:A.NaHCO3与NaOH溶液反应,离子方程式:HCO3-+OH-═CO32-+H2O,故A正确;
B.氯气和水反应,离子方程式:Cl2+H2O?H++Clˉ+HClO,故B错误;
C.氯化铁溶液中加入足量的氨水,离子方程式:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故C正确;
D.二氧化硅与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH-═SiO32-+H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查复分解反应离子方程式书写,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,注意化学式的拆分.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 在密闭容器中加热CuO制1000℃ | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
| B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
| D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 | |
| D. | 将1molCu置于含2molH2SO4的浓溶液中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 请根据如图回答:
请根据如图回答:
 .
. ;
;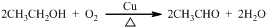 .
. +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
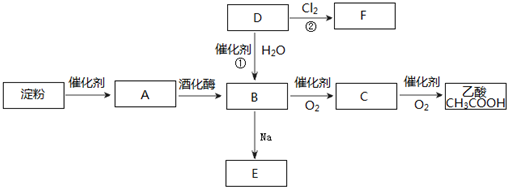
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com