
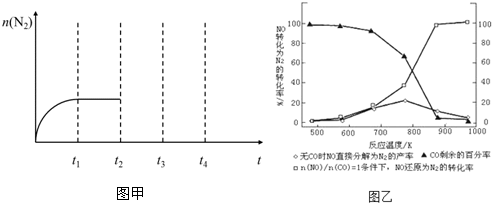
���� ��1��������Ŀ��Ϣ��Kp����������ƽ���ѹ�ݴη��˻����Է�Ӧ��ƽ���ѹ�ݴη��˻���
��2���ٸ�������ʽ��ʾ��ƽ��ʱ��Ӧ����ֵ������ȽϷ�Ӧ��ƽ�ⳣ��k��Qc�Ĵ�С�жϷ�Ӧ���еķ���
������������������������t2ʱ�̣�������Ѹ��ѹ����ԭ�ݻ���һ�룬˲�䵪�����ʵ������䣬ѹǿ����ƽ�������ƶ����������ʵ�������ƽ��ʱ���ֲ��䣻
��3������ʹ��CO���¶ȳ���775K���ң�NO�ķֽ��ʽ��ͣ�˵�������¶�ƽ�������ƶ���
��4����֪����N2��g��+O2��g���T2NO��g����H=+180.5kJ•mol-1
��2C��s��+O2��g���T2CO��g����H=-221kJ•mol-1
��2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-745.5kJ•mol-1
���ݸ�˹���ɣ�����+��+�ڣ���2�ɵã�C��s��+O2��g��=CO2��g����
��� �⣺��1��������Ŀ��Ϣ��Kp����������ƽ���ѹ�ݴη��˻����Է�Ӧ��ƽ���ѹ�ݴη��˻�����2NO��g��+2CO��g��?N2��g��+2CO2��g����Kp=$\frac{p��{N}_{2}��•p^2��C{O}_{2}��}{p^2��NO��•p^2��CO��}$��
�ʴ�Ϊ��$\frac{p��{N}_{2}��•p^2��C{O}_{2}��}{p^2��NO��•p^2��CO��}$��
��2����������Ϊ1L��һ���¶��£����ܱ������г���һ����NO��CO����t1ʱ�̴ﵽƽ��״̬����ʱn��NO��=2a mol��n��CO��=a mol��n��N2��=b mol����������ʽ��
2NO��g��+2CO��g��?N2��g��+2CO2��g��
��ʼ����mol����2a+2b a+2b 0 0
�仯����mol����2b 2b b 2b
ƽ������mol����2a a b 2b
����¶��·�Ӧ��ƽ�ⳣ��k=$\frac{��2b^2��•b}{��2a��^2•a^2}$=$\frac{b^3}{{a}^{4}}$������������䣬���������г���a mol NO��2b mol CO2����ʱ��Ӧ��Ũ����Qc=$\frac{��2b+2b��^2•b}{��2a+a��^2•a^2}$=$\frac{16b^3}{9{a}^{4}}$��k��˵����Ӧ�����淽����У�v����v����
�ʴ�Ϊ������
������������������������t2ʱ�̣�������Ѹ��ѹ����ԭ�ݻ���һ�룬˲�䵪�����ʵ������䣬ѹǿ����ƽ�������ƶ����������ʵ�������ƽ��ʱ���ֲ��䣬t2-t3-t4ʱ��N2���ʵ����ı仯����Ϊ��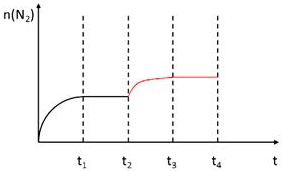 ��
��
�ʴ�Ϊ��
��3������ʹ��CO���¶ȳ���775K���ң�NO�ķֽ��ʽ��ͣ�˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��4����֪����N2��g��+O2��g��=2NO��g����H=+180.5kJ•mol-1
��2C��s��+O2��g��=2CO��g����H=-221kJ•mol-1
��2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-745.5kJ•mol-1
���ݸ�˹���ɣ�����+��+�ڣ���2�ɵã�C��s��+O2��g���TCO2��g����=-393KJ•mol-1��
�ʴ�Ϊ��C��s��+O2��g���TCO2��g����=-393KJ•mol-1��
���� ���⿼���˹���ɵ�Ӧ�á����ȷ�Ӧ�����ȷ�Ӧ���Ȼ�ѧ����ʽ����д���Ѷ��еȣ�����ͼ��������ֽ��ʵı仯�ص��ǽ���Ĺؼ���


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ҷ����������ᣬ�����ǻ�ѧѧϰС���ͬѧ�Բ��ᾧ�壨H2C2O4•xH2O�����е�̽����ѧϰ�Ĺ��̣�������벢Э������������ѧϰ����
�Ҷ����������ᣬ�����ǻ�ѧѧϰС���ͬѧ�Բ��ᾧ�壨H2C2O4•xH2O�����е�̽����ѧϰ�Ĺ��̣�������벢Э������������ѧϰ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
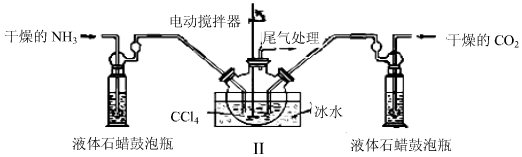
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
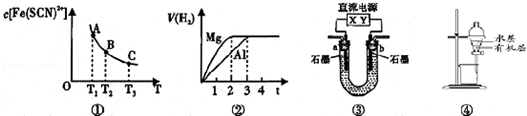
| A�� | ��֪ͼ������ϵFe3+��aq��+SCN-��aq��?Fe��SCN��2+��aq���е�c[Fe��SCN��2+]���¶�T��ƽ��ͼ��A����B����ȣ�A���c��Fe3+����С | |
| B�� | ͼ�ڱ�ʾþ�����ֱ����Ũ�ȡ�������Ĺ���ϡ���ᷴӦ��������������V ��ʱ��t�Ĺ�ϵ����Ӧ��þ�����ķ�Ӧ����֮��Ϊ2��3 | |
| C�� | ͼ��ֱ����ԴY��Ϊ������U�ι���ΪAgNO3��Һ����b���е缫��Ӧʽ�ǣ�4OH--4e-�TO2��+2H2O | |
| D�� | ͼ�ܱ�ʾ����CCl4��ȡ��ˮ���ѷֲ���л����ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2��������ԭ�� | B�� | 2H��������Ԫ�� | ||
| C�� | 2H2O������ˮ���� | D�� | Ca2+����Ԫ�صĻ��ϼ�Ϊ+2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com