
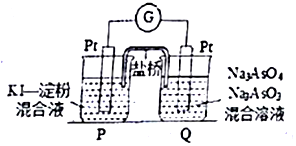
 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)分析 (1)与砷同族的原子半径最小的元素为氮元素,形成的单质为氮气,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,根据化合价的变化分析;
(3)NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解;HAsO32-在溶液中电离程度小于水解程度;
(4)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=$\frac{c({H}_{2}As{{O}_{4}}^{-})c({H}^{+})}{c({H}_{3}As{O}_{4})}$,以第一步电离为主;
②电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH.当P池中溶液由无色变成蓝色时,说明P池发生的是负极氧化反应,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,据此可写出电极反应方程式,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,电子应由负极流向正极.
解答 解:(1)与砷同族的原子半径最小的元素为氮元素,形成的单质为氮气,电子式为 ,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱,气态氢化物NH3的稳定性比AsH3 强,
,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱,气态氢化物NH3的稳定性比AsH3 强,
故答案为: ;强;
;强;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2,
故答案为:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解,其水解方程式为:;HAsO32-在溶液中电离程度小于水解程度,以水解为主,水解生成H2AsO3-,则该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O?H2AsO3-+OH-;>;
(4)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=$\frac{c({H}_{2}As{{O}_{4}}^{-})c({H}^{+})}{c({H}_{3}As{O}_{4})}$,以第一步电离为主,则c(H+)≈$\sqrt{{K}_{1}×c({H}_{3}As{O}_{4})}$=$\sqrt{6×1{0}^{-3}×0.6}$=0.06mol/L;
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
点评 本题以As及其化合物的性质为知识背景,涉及水解平衡与电离平衡、氧化还原反应的分析与计算、原电池原理及平衡的移动等,属基础考综合应用的考查,难题目度中等,对提高学生分析问题解决问题的能力培养有一定帮助.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的溶质质量分数变大 | B. | 溶液仍为饱和溶液 | ||
| C. | 溶液中的Na+数目减小 | D. | 溶液中的c(Na+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 0.2 mol•L-1的NaHSO3溶液中pH<7,则溶液中一定有:c(H2SO3)<c(SO32-) | |
| B. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
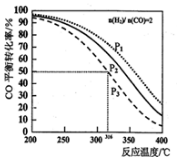
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试验操作 | 现象 | 结论 |
| A | 向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液 | 先看到蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 测量熔融状态下NaHSO4 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、SO42- |
| C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变化 | 原溶液中无NH4+ |
| D | 向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com