
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
分析 A.铁离子具有氧化性,能够氧化碘离子;
B.碱性溶液中存在大量氢氧根离子,铝离子与氢氧根离子反应;
C.该溶液中存在大量氢离子,次氯酸根离子能够与氢离子反应生成次氯酸;
D.铵根离子与氢氧根离子加热反应生成氨气,钙离子、碳酸氢根离子与氢氧根离子反应生成碳酸钙沉淀.
解答 解:A.Fe3+I-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.Al3+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.pH=1的溶液为酸性溶液,溶液中存在大量氢离子,ClO-与氢离子反应生成弱电解质次氯酸,在溶液中不能大量共存,故C错误;
D.Ca2+、HCO3-、NH4+、Cl-之间不发生反应,且加入强碱再加热,Ca2+、HCO3-与强碱性溶液中的氢氧根离子反应生成碳酸钙沉淀,NH4+、OH-在加热条件下生成氨气,满足条件,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2属于大气污染物 | |
| B. | 酸雨是PH小于7的雨水 | |
| C. | 硅酸钠溶液应保存在带玻璃塞的试剂瓶中 | |
| D. | 大气中CO2含量的增加会导致温室效应加剧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
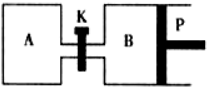 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某反应的焓变小于零,该反应一定能自发进行 | |
| B. | 用湿润的PH试纸测稀盐酸溶液的pH为3.52 | |
| C. | 原电池是将化学能转变为电能的装置 | |
| D. | 草木灰(K2CO3)是钾肥,硫酸铵是氮肥,两者混合施用可以提高肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | NH4Al(SO4)2溶液与足量的Ba(OH)2溶液混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 铅酸蓄电池充电时的阴极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 3.92L | C. | 3.36L | D. | 2.8L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com